-
新型冠状病毒SARS-CoV-2是一种与SARS-CoV和MERS-CoV病毒类似的冠状病毒。SARS疫情在2002~2003年对世界多个国家地区造成严重影响。MERS-CoV病毒于2012年在沙特出现,疫情主要发生在中东国家和韩国,其他国家地区偶有发生。
SARS和MERS的动力学研究已有一些进展。目前对流行病传染动力学研究的数学模型主要有确定性模型和随机模型。文献[1]得到SARS的平均潜伏期约为6.4天,从出现临床症状到入院的平均时间在3~5天。在病死率方面,60岁以下的患者的病死率为13.2%,而60岁以上患者的病死率为43.3%。潜伏期和病死率会影响SARS的病例变化。文献[2]研究得出在未采取控制措施的情况下,一个传染性非典型肺炎病例会感染约2~3个继发病例,采取有力的公共卫生措施能降低疫情规模。文献[3]对香港SARS疫情进行分析,发现SARS疫情的特征包括单独的超级传播事件(SSEs)和持续的社区传播。在疫情初期,平均每个病例产生2.7次继发性感染,其中很大一部分来自医院传播。传播率在流行期间下降,主要是由于人口接触率下降和医院感染控制得到改善。文献[4]建立了SARS流行病的数学模型,计算出模型参数,分析了SARS流行特征,并对疫情发展进行了预测。文献[5]利用部分国家、地区及中国内地部分城市的数据,通过Logistic确定型增长模型进行拟合,揭示了各个地区SARS传染力不均匀的现象以及防控措施上的差异。文献[6]建立了带有潜伏期及终身免疫的SARS流行病的SEIR动力学模型,对模型中的参数进行了参数辨识,得到了一个SARS流行病的控制区域。文献[7]建立了带有潜伏期及终身免疫的SARS流行病SEIR模型及参数辩识系统,论证了该类控制模型的主要数学性质以及系统的流不变性和弱不变性。文献[8]研究了埃博拉流行病的传染动力学模型及其参数辨识问题,构建了埃博拉流行病的离散logistic动力学模型,给出了参数辨识优化问题。文献[9]研究了多关系网络上的流行病传播动力学问题,提出一种双关系网络模型(工作−朋友关系网),研究了多关系对流行病传播动力学行为的影响和复杂网络上流行病传播动力学的爆发阈值[10],梳理总结了SIS和SIR模型爆发阈值的异同。文献[11]研究了MERS在组织间公共卫生应急管理网络的动态发展,绘制了MERS爆发期间的沟通和响应网络模式。文献[12]研究了2015年韩国中东呼吸综合征(MERS)疫情异质性传播动态的决定因素,利用传播树识别超级传播者,估计不同类型宿主的再生产数,即单个主病例产生的平均继发病例数。文献[13]为了识别复杂网络中的超级传播者,提出了一种融合指数−扩展影响相关中心度,通过提取和综合传统中心度指标和扩展影响拓扑特征信息来识别节点的影响。经典的SIR(易感染−恢复)模型描述了感染的传播过程。人们对流行病的反应影响传播,因此许多研究也考虑了信息传播。文献[14]分析了信息传播的操作如何影响受感染的个体以及流行病的传播条件,并基于社区规模和个人意识可能对感染率有影响的假设,提出了一个SIR-A(易感−恢复−活动)模型,将感染和信息传播映射到双层网络。文献[15]使用复杂网络的演化博弈模型研究了流行病传播过程,通过假设个人在疾病传播过程中将自己的收益与相邻个体的收益进行比较来选择策略,使用4种不同的仿真原则来更新策略,分析了违反直觉的现象,发现不同的仿真原则会影响违反直觉的现象的范围和严重性。文献[16]通过独立传播者参与的流行病SIS(易感−感染−易感)调查,解释了在发生扩散动力学的复杂系统中,通常具有许多潜在关系可以促进传染病的传播过程。文献[17]研究人类行为和接触异质性对传染病传播的影响,在考虑与他人潜在接触次数不同的个体的不同恐惧程度基础上,提出了具有一般反馈机制的基于网络的SIRS流行病模型。文献[18]提出了一种基于复杂网络中的部分免疫和免疫无效性的新型病毒传播模型,即易感性−感染性−易感性−恢复性−易感性,并基于均值场理论研究了该模型在统一网络和无标度网络中的流行动力学行为。对于复杂网络中的传染动力过程,可以从社会人口数据中模拟感染传播过程[19],此外,关键节点识别和共同进化传播机制在流行病传播的控制中至关重要[20-21]。文献[22]基于复杂网络理论建立了带有潜伏期的2019-nCoV流行病SEIR动力学模型,对疫情拐点进行了预测。以上工作从确定性模型、随机性模型、复杂网络传播动力学等方面研究了SARS-CoV和MERS-CoV的传播规律,但是对于SARS-CoV-2的传播研究仍然不够。
目前,COVID-19作为一种新型传染病,其传播机制尚不明确。虽然,SARS-CoV-2与SARS-CoV和MERS-CoV同为冠状病毒,但是其传染特性与后两者有何区别,仍然有很多问题需要研究。
HTML
-
对传染病感染人数进行研究分析,假设t时刻的感染人数为N(t)。在新型冠状病毒发生初期,人们对病原体、传播途径等方面缺乏充分认识,导致对传染病的防控不够重视,在新型冠状病毒发生初期感染人数的增长率可以看做常数
${r_0}$ 。但当感染病例达到一定数量时,感染人数的增长率随着感染人数N的增加而减少,增长率函数$r(N)$ 为$N$ 的单调递减函数。简单起见,不妨假设增长率为感染人数的线性函数,$r(N) = {r_0} - sN$ 表示人们没有采取任何措施并且任由病毒随意传播的增长率,$s$ 为传染抑制常数,反映人们所采取的防控措施对传染病的抑制效果。$s$ 越大,表示人们所采取的防控措施效果越明显。假设在病毒传染力和防控措施的共同作用下,感染的最大人数为${N_{\max }}$ ,即可以得到当$N = {N_{\max }}$ 时,增长率$r({N_{\max }}) = 0$ 。此时,可以得到传染抑制常数$s = {r_0}/{N_{\max }}$ 。 -
根据模型假设,在连续模型下,单位时间
$\Delta t$ 内增加的感染者人数$\Delta N$ 可以表示为增长率$r(N)$ 与$N$ 的乘积,并且${t_0}$ 时刻的感染人数为${N_0}$ ,因此可以得到感染人数微分方程的初值问题:式中,等式第一项
${r_0}N$ 表示在无防控措施情况下传染病的自然流行趋势;第二项$ - {r_0}{N^2}/{N_{\max }}$ 表示防控措施对传染病流行产生的效果。在传染病流行初期,由于缺乏有力的传染病防控措施,疫情的发展规律主要受病毒本身的传染特性影响,第一项起到主导作用,这时可以认为$ - {r_0}{N^2}/{N_{\max }} = 0$ ,此时微分方程的解为:这说明在无人为干预的情况下任病毒随意传播,感染者人数呈多代指数级增长。在传染病爆发期,第二项的作用开始逐渐占据主导地位,新增发病人数逐渐减少并趋向于零,传染病得到控制。
式(1)是一个可分离变量的微分方程初值问题,可以解得:
可得
$N(t)$ 的二阶导数为:根据式(3)和式(4)可以得到感染人数的两个规律:
1)
$\mathop {\lim }\limits_{t \to + \infty } N(t) = {N_{\max }}$ ,这说明无论在${t_0}$ 时刻感染人数的初始值${N_0}$ 如何,感染人数的极限总是${N_{\max }}$ ;2)由
$N(t)$ 的二阶导数可以知道,感染者变化率${\rm{d}}N/{\rm{d}}t$ 在$N = {N_{\max }}/2$ 时取得最大值,即感染者人数达到极限值一半时是加速增长时期。这一点之后,新增感染人数会逐渐变小,并最终变为零。因此,在$N = {N_{\max }}/2$ 所对应的时刻可以称之为新增感染人数的拐点。 -
传染病所感染的人数从
$N$ 变化到$2N$ 的时间跨度称之为倍增周期。如果在无人为干预的情况下,根据式(2),可以得到倍增周期${T_0} = \ln 2/{r_0}$ 。倍增周期${T_0}$ 仅依赖于无人为干预的感染人数增长率${r_0}$ 。在采取防护措施等人为因素干预下,倍增周期将不仅仅依赖于增长率
${r_0}$ 。由式(3)可以得到$N(t)$ 的反函数:假设
${t_1}$ 时刻的感染人数为$N$ ,${t_2}$ 时刻的感染人数为$2N$ ,则可以得到倍增周期:式中,函数
$T$ 是关于感染人数$N$ 的函数,且要求${N_{\max }} - 2N > 0$ ,其导数为:可知
$T$ 为单调递增函数,当$N \to 0$ 时,$T \to {T_0}$ ,而当$N \to {N_{\max }}/2$ 时,$T \to \infty $ 。这说明,当出现拐点时,感染人数的倍增现象则不再出现。
1.1. 模型假设
1.2. 模型建立
1.3. 倍增周期的计算
-
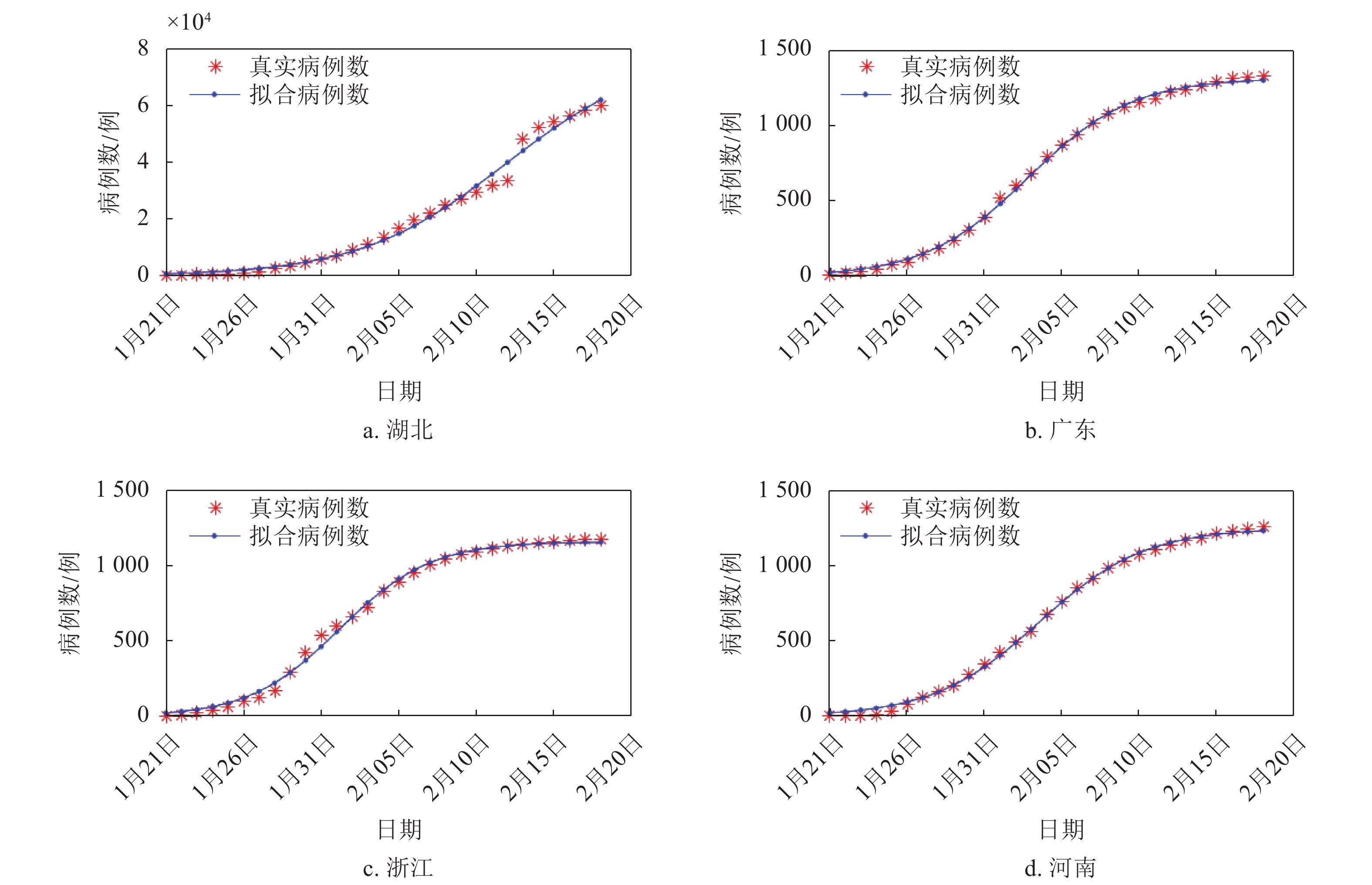
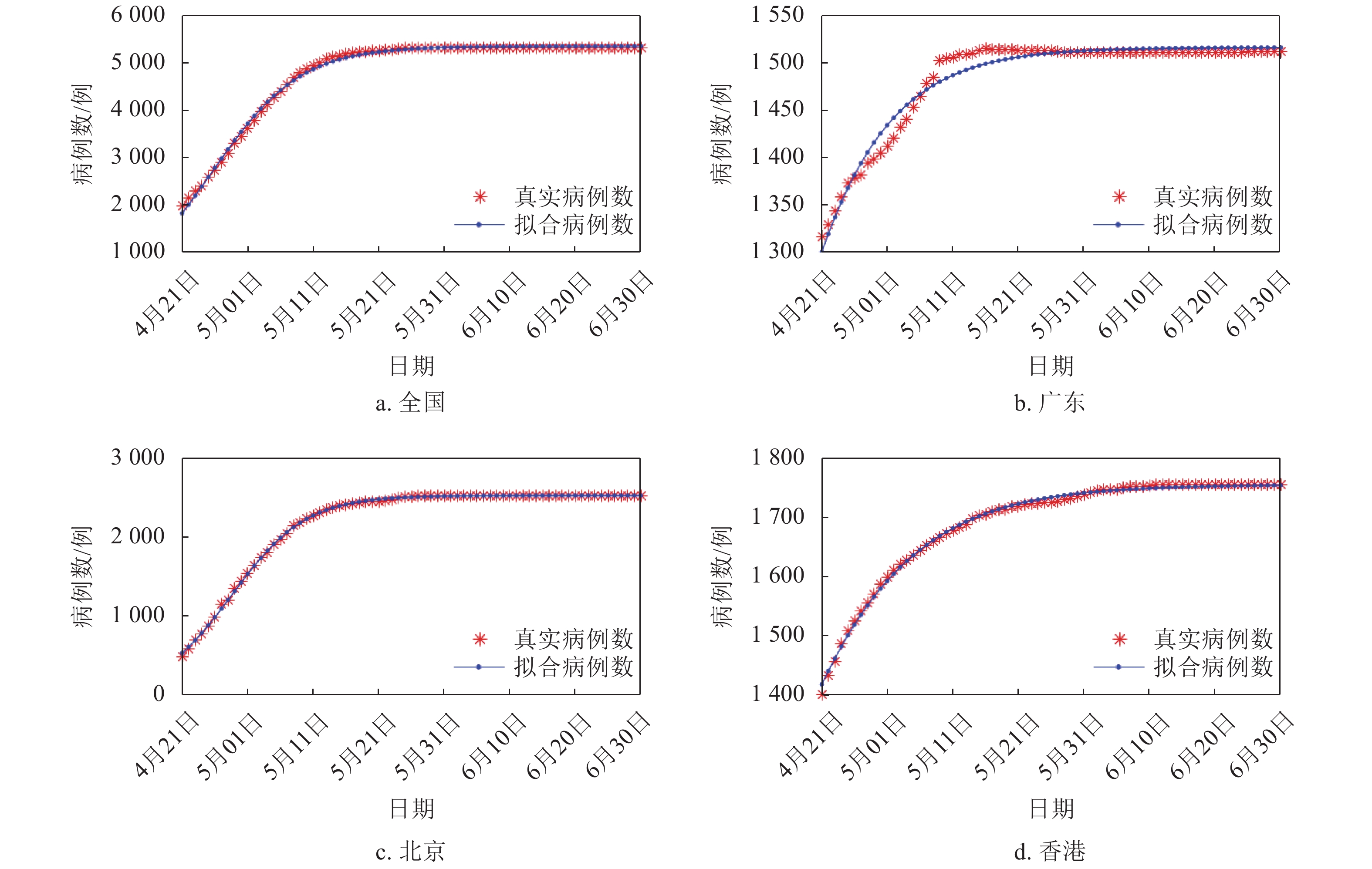
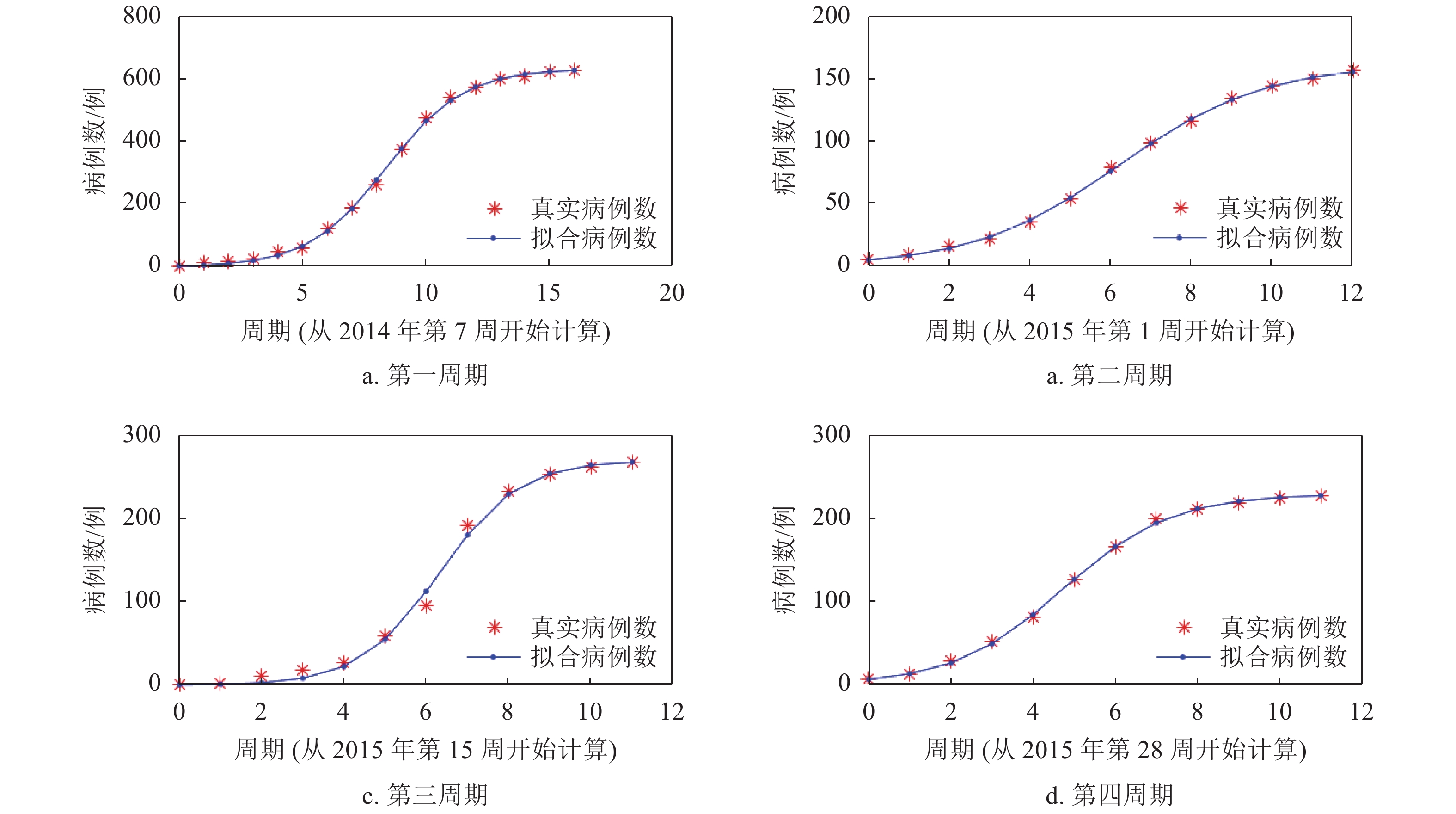
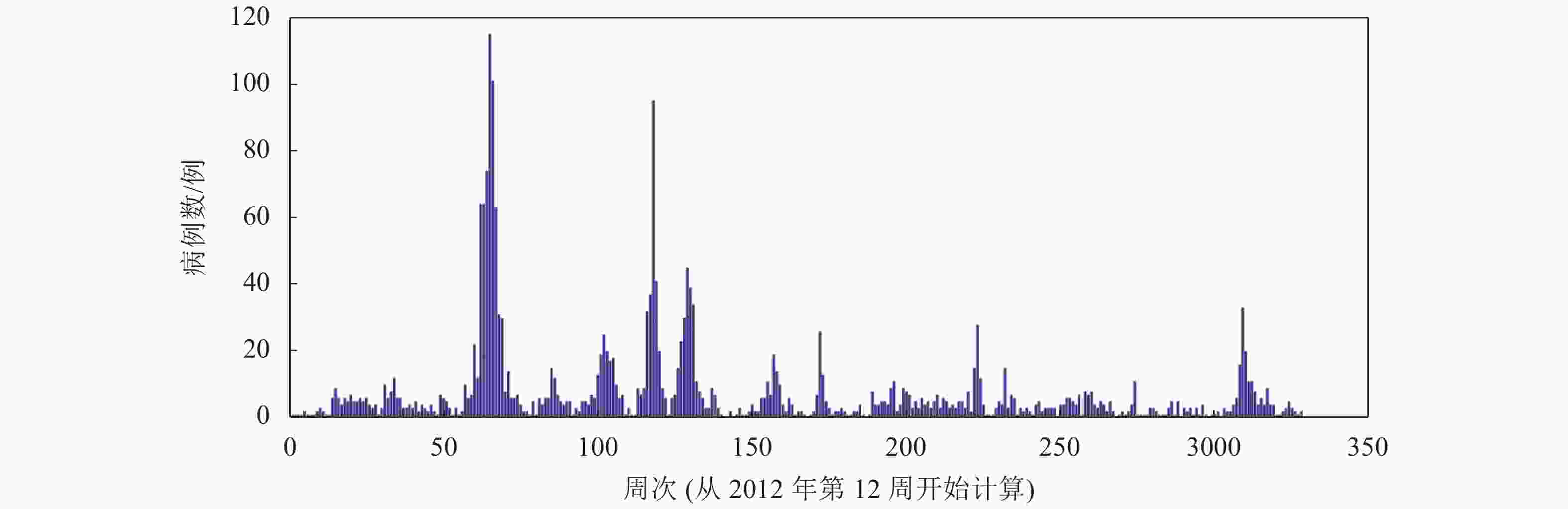
本文采用的数据均来自世界卫生组织(WHO)(http://www.who.int)和国家卫生健康委员会官方网站(http://www.nhc.gov.cn/)。国家卫生健康委员会自2020年1月20日起公布新型冠状病毒SARS-CoV-2的确诊病例和新增确诊病例数据,本文选择SARS-CoV-2的数据起止日期为2020年1月20日−2020年2月16日,选取的地区分别是湖北(HB)、广东(GD)、浙江(ZJ)、河南(HN)。SARS-CoV病毒确诊病例数据选择的起止日期为2003年4月21日−2003年6月30日,选取的国家地区分别是全国(Nat)(不包括香港、澳门和台湾地区)、广东(GD)、北京(BJ)、香港(HK)。图1给出了沙特阿拉伯从2012年第12周~2019年第24周的每周MERS-CoV感染人数的柱状图。可见,沙特阿拉伯经历了4次明显的MERS疫情爆发,分别是2014年第7周~第23周、2015年第1周~第12周、2015年第15周~第26周、2015年第28周~第39周,这4个爆发周期分别记为C#1、C#2、C#3、C#4。选取这4个周期的MERS发生病例进行分析。本文应用1stOpt软件进行方程拟合,拟合过程采用Levenberg-Marquardt优化算法。
-
利用式(3)的模型对COVID-19、SARS和MERS在各个地区发生的病例数进行拟合,拟合效果显著。表1给出了拟合的结果,其中相关系数是度量所研究变量之间线性相关的程度,其取值范围是0~1,越接近1表示变量之间的相关程度越高;决定系数定义为回归方程中因变量的已解释离差与总变差的比值,反映回归方程的因变量变化可靠程度,其取值范围也是0~1,越接近1表示方程拟合效果越好。从相关系数和决定系数看,他们的最小值分别是0.982 2和0.964 7。除了湖北的COVID-19病例数外,
${N_{\max }}$ 与真实病例数都相当接近,平均相对误差的绝对值在0.03%以下。湖北的COVID-19的真实病例数59 989例是截至2020年2月18日的确诊累计病例,目前在湖北的确诊新增病例仍然在每日1 000~2 000例之间,预测疫情结束之后,湖北的确诊累计病例将达7万多例。肺炎 地区 相关系数(R) 决定系数(DC) 增长率r0 传染抑制常数$s$$( \times {10^{ - 4}})$ ${N_{\max }}$拟合值/例 真实病例数/例 平均相对误差/% COVID-19 HB 0.994 8 0.989 6 0.211 0.027 78 920.010 59 989 31.56 GD 0.999 4 0.998 7 0.298 2.270 1 314.416 1 328 −1.02 ZJ 0.998 4 0.996 4 0.343 2.957 1 159.926 1 172 −1.03 HN 0.999 3 0.998 4 0.293 2.344 1 249.659 1 257 −0.58 SARS Nat 0.998 4 0.996 7 0.148 0.276 5 355.991 5 327 0.54 GD 0.982 2 0.964 7 0.107 0.703 1 516.151 1 512 0.27 BJ 0.999 7 0.999 4 0.176 0.697 2 520.522 2 521 −0.02 HK 0.998 6 0.997 2 0.085 0.482 1 755.788 1 755 0.04 MERS C#1 0.999 6 0.999 2 0.091 1.434 632.762 629 0.60 C#2 0.999 7 0.999 4 0.079 4.899 161.823 157 3.07 C#3 0.998 1 0.995 7 0.148 5.482 269.475 267 0.93 C#4 0.999 7 0.999 4 0.108 4.736 228.499 227 0.66 对于COVID-19,选取了疫情较为严重的4个省份进行模型拟合,分别是湖北、广东、浙江、河南。湖北在2020年2月13日统计确诊病例时,统计方式发生改变,将SARS-CoV-2核酸检测确诊改为临床确诊,导致确诊病例出现跳跃性递增。2月13日当天湖北新增确诊病例14 840。因此在图2中,累计病例在2020年2月13日有一个跳跃过程。总体来说,4个省份的模型拟合效果都较好。
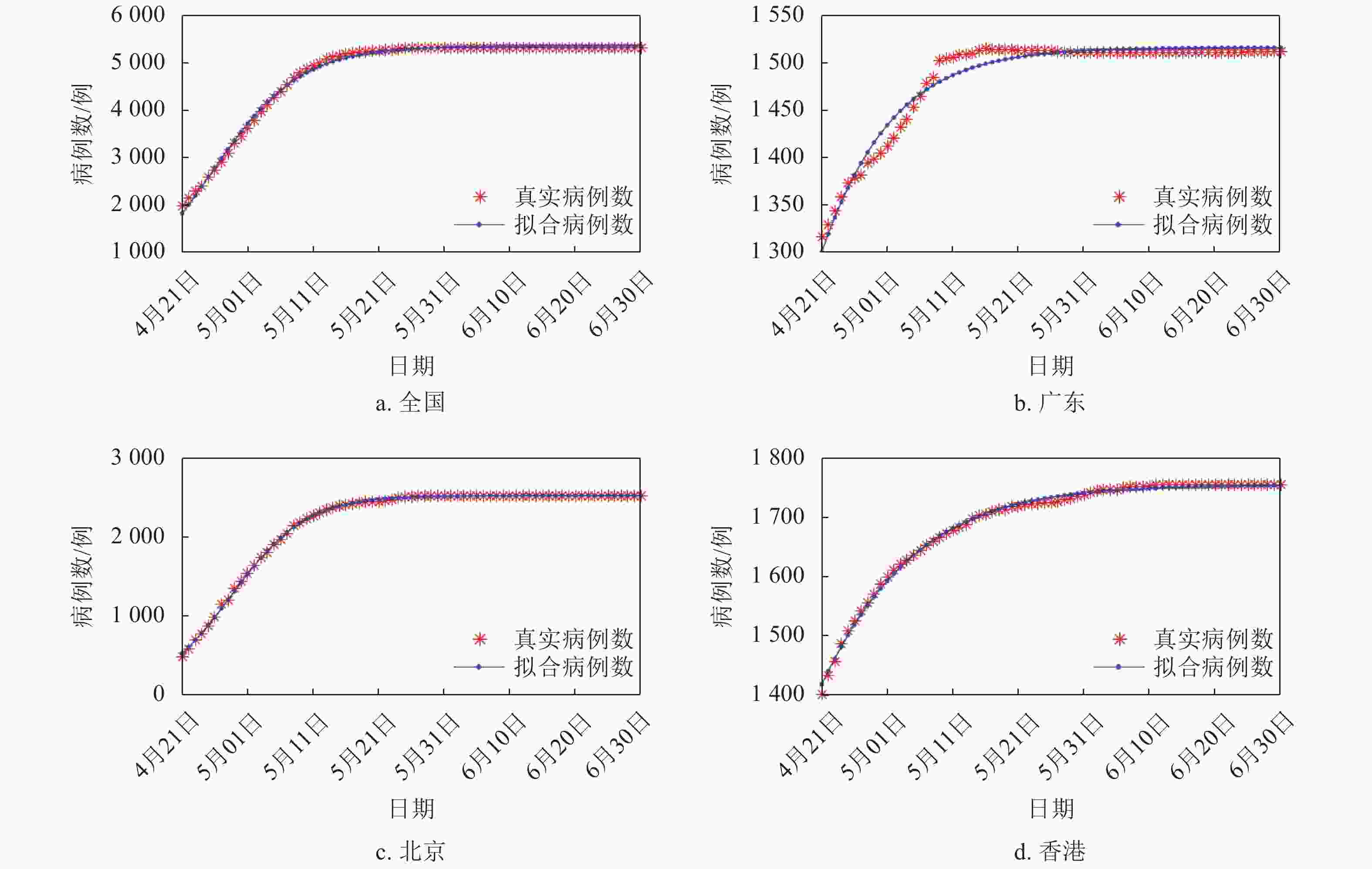
SARS病例在中国各省份发生的情况与COVID-19不同。截至2020年2月18日,中国内地(不包括香港、澳门和台湾地区)累计发生COVID-19共72 436例,其中湖北59 989例,湖北的累计病例占据了中国内地病例的绝大部分。2003年,SARS在中国多个主要省份均有发生,疫情较为严重的几个主要省份所发生的病例数量之间并没有明显的差异。因此,在地区病例数上,选取了中国内地(不包括香港、澳门和台湾地区)的病例数以及广东、北京、香港这几个地区的病例数。拟合结果如图3所示,拟合效果较好。
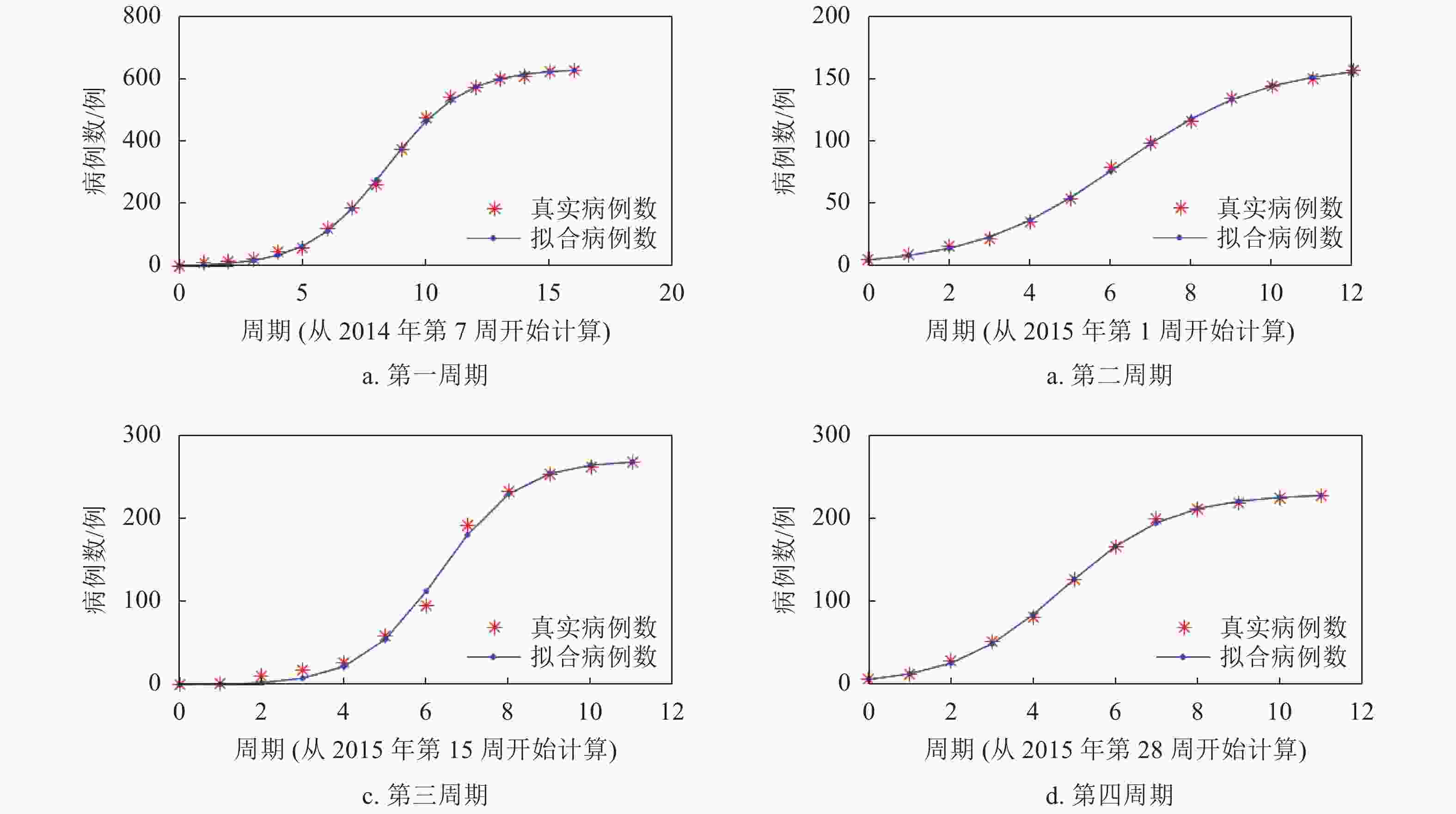
对于MERS,沙特阿拉伯经历了4次明显的MERS疫情爆发周期。对这4个周期的MERS病例的模型拟合如图4所示。这4个周期的平均相对误差最大的是第2个周期,为3.07%,总体拟合效果较好。
-
增长率
${r_0}$ 主要反映传染病自然传染的能力,它受多个因素的影响,包括病毒本身的传染性强弱、人口流动情况和民众的卫生素质。人口密度虽然也会影响传染病的传播,但对传播的影响并不十分明显。对于SARS-CoV-2的增长率${r_0}$ ,由表1可知,湖北、广东、浙江、河南4个地区的增长率介于0.2~0.35之间,平均值为0.286,相互之间的差异并不十分明显。就SARS-CoV来说,北京的增长率约为香港的两倍。这可能与北京的人口基数较大、人口流动较快有关。MERS-CoV病毒在沙特发生的4个周期的增长率相差不明显,平均值为0.106。将3种冠状病毒的传播能力进行比较发现,SARS-CoV-2的增长率明显比SARS-CoV和MERS-CoV的增长率大得多。SARS-CoV-2的增长率约为SARS-CoV增长率的两倍,说明SARS-CoV-2的传染力比SARS-CoV要大的多。这就解释了在中国COVID-19疫情比2003年的SARS疫情病例增长快得多的原因。倍增周期与增长率的倒数有关,SARS-CoV和MERS-CoV的倍增周期相当,都是5~10天,而SARS-CoV-2的倍增周期只有2~3天,与文献[23]的分析吻合,在指数增长作用之下,SARS-CoV-2的患病人数会迅速增加。
-
传染抑制常数
$s$ 与一些人为干预因素有关,主要包括将染病者与正常人隔离,将确诊病例与疑似病例隔离,民众对传染病的重视程度,对疾病流行区的清洁消毒。这些人为干预措施与疫情发生后当地政府、医疗机构所采取的措施有密切关系,反映政府管理部门和医疗卫生部门对疫情的应急管理能力。原则上来说,疫苗也属于人为干预因素之一,但是这3种冠状病毒目前都没有疫苗。传染抑制常数$s$ 越大,则反映所采取的人为干预措施越及时有效,疫情越容易在短时间内被控制。反之,则表示疫情越容易失控。3种冠状病毒SARS-CoV-2、SARS-CoV和MERS-CoV的传染抑制常数表现出显著差异,见表1。对于SARS-CoV,全国内地、广东、北京、香港的差异不大,都在一个数量级
${10^{ - 5}}$ ,广东和北京相当,约为全国总体情况的两倍。MERS-CoV的传染抑制常数比SARS-CoV高一个数量级,为${10^{ - 4}}$ ,第一至第四周期几乎是逐渐递增,这说明沙特在MERS疫情后续爆发周期采取了更强的应急干预措施,阻断MERS-CoV病毒传染。在广东、浙江、河南,SARS-CoV-2的传染抑制常数与MERS-CoV同一个数量级。但是,在湖北,SARS-CoV-2的传染抑制常数为$2.7 \times {10^{ - 6}}$ ,比广东、浙江和河南低两个数量级。这就解释了COVID-19在湖北失控的原因。当然,广东、浙江和河南的传染抑制常数比湖北高的多,也得益于湖北所采取的强有力的“封城”措施。2020年初,广东、浙江和河南也较早启动突发公共卫生事件一级响应,使得政府管理部门、卫生管理部门和民众都采取了较为积极的应对措施。中国绝大部分省市最后都启动突发公共卫生事件一级响应,要求民众在家隔离、外出戴口罩,提高个人卫生要求。而针对湖北省内来说,由于染病者众多,早期而言,湖北的医疗机构应付不暇,医院的病床、设备、药品、口罩、防护服等物资严重不足,导致染病者不能有效隔离,因此导致湖北的传染抑制常数显著偏高。
3.1. 拟合结果
3.2. 增长率和倍增周期
3.3. 传染抑制常数
-
本文建立了传染病的动力学数学模型,分别利用该模型分析了SARS-CoV-2、SARS-CoV和MERS-CoV的流行特点。传染病增长率决定了传染病初期的流行程度,而传染抑制常数取决于各地采取的防控措施。3种冠状病毒动力学模型的参数分析合理解析了3种冠状病毒传播的特点以及疫情爆发过程中各地所采取的措施。SARS-CoV-2的增长率比SARS-CoV和MERS-CoV的增长率大得多,倍增周期约为SARS-CoV和MERS-CoV的1/2。在湖北,SARS-CoV-2的传染抑制常数比其他地区低两个数量级,使得湖北地区的疫情比其他地区严重得多。

 ISSN
ISSN 






























































 DownLoad:
DownLoad: