2. 中国科学院大学电子电气与通信工程学院 北京 石景山区 100049
2. School of Electronic, Electrical and Communication Engineering, University of Chinese Academy of Sciences Shijingshan Beijing 100049
神经系统是由神经组织构成的器官系统,是人体中最为复杂也最为重要的系统之一,其包括了数十亿的神经元和多种感官信息传递机制。单个神经元的信息传递是由电信号和递质信号共同完成的,这两类信号在神经系统中起着重要的作用[1, 2, 3, 4]。因此研究神经电生理信号和递质电化学信号的同步检测,对于神经系统的进一步研究具有重要的意义[5]。
碳纤维电极、玻璃微电极等是人们检测神经细胞电生理信号的常用器件,但使用这些工具电极定位困难,操作繁琐,且容易造成细胞损伤,使得无法长期监测[6, 7, 8, 9, 10]。近年来,随着微机电系统(microelectromechanical systems,MEMS)加工技术的发展,微电极阵列芯片使得在体或离体条件下对神经细胞的长期无损监测提供了可能,如德国Multichannel公司开发的MEA芯片,密歇根大学研发的密歇根电极等[7, 11, 12]。这些电极可实现群体神经细胞电生理活动的同步检测,然而之前使用的微电极阵列没有集成电化学检测神经递质的功能,且获得信号的信噪比较低,这是因为裸电极或者修饰的材料灵敏度不高,检测限低,与离体组织不易接触。
石墨烯目前是世界上电阻率最小的材料,电阻率只约为10-6 Ω×cm,还兼有高热导性和高机械强度的优良性质,但石墨烯的强疏水、易团聚的特性限制了其应用,而氧化石墨烯(graphene oxide,GO)因含有大量的含氧官能团能解决了以上不足[13, 14],因而GO能在电子、材料、信息等领域有广阔的应用前景。吡咯单体在氧化剂的存在下能较迅速地氧化成聚吡咯(polypyrrole, PPy),PPy与其他高分子相比具有电导率高、易成膜、柔软、生物相容性好的优点,且吡咯易于和其他材料复合,所以PPy在电极修饰、离子检测方面广泛地被应用[15]。
1 材料与方法 1.1 仪器与试剂氧化石墨烯(纯度>99%,南京先丰纳米材料科技有限公司);吡咯单体(纯度>99%,sigma)实验用水为去离子水;电化学工作站CHI660D (上海辰华仪器有限公司);S4800型扫描电镜(日本日立公司);超声分散仪(上海新苗医疗器械制造有限公司)。
1.2 神经微电极阵列芯片的制备利用微机电系统加工工艺(MEMS),实验室自制了60通道的神经微电极阵列芯片。芯片在玻璃基底上集成了便于神经检测的绝缘基底、焊盘、引线、微电极阵列、参考电极、对电极、复合敏感膜材料以及绝缘层,其中微电极的直径为20 μm,电极间距150 μm,线宽10 μm;包括两次光刻过程。在光刻之前对玻璃基底依次经过丙酮、乙醇、去离子水的清洗以确保基底表面洁净,第一次光刻步骤为:旋涂一层AZ1500正性光刻胶,随后进行前烘、曝光、显影、后烘的操作;随后,溅射一层厚度约为250 nm的钛、铂(Pt/Ti)金属层;剥离多余的金属,仅剩下焊盘、引线、微电极阵列、参考电极、对电极;并利用等离子体增强化学气相沉积法(PECVD)沉积厚度约为400 nm的Si3N4。第二次光刻即为套刻,操作步骤与初次光刻一致。操作完成后,对芯片进行深刻蚀,本芯片制作采用干法刻蚀。干法刻蚀就是通过气体和等离子体能量对光刻胶暴露区域进行化学反应,使微电极暴露出来[10, 16]。
1.3 聚吡咯氧化石墨烯(PPy/GO)的电化学聚合计时电压法和计时电流法是常用的电化学电镀方法。本文采用计时电压法探究PPy/GO合成的条件。电化学聚合分如下步骤:1) 取1 mL的GO悬浊液(1 mg/mL)超声分散25 min,期间不停通入N2; 2) 量取3.47 μL的吡咯滴入GO中,并继续超声分散 15 min;3) 将此混合液在磁力搅拌器中搅拌2 min;4)电镀实验采用计时电压法在三电极体系中进行,对不同的微电极点选择不同的电量密度,分别为0.08、0.2、0.3、0.5、0.8 C/cm2。
1.4 PPy/GO电化学行为完成上述电聚合实验后,首先,将神经微电极阵列浸入已配制好的50 μM多巴胺溶液(DA)中,采用三电极体系在-0.3~0.7 V的电位范围内进行循环伏安扫描10次,其中扫描速度为0.05 V/s。其次,将微电极浸入1 mL 0.9%NaCl溶液中,测试最佳电聚合沉积的微电极和裸Pt电极的阻抗谱图,其中电压设置为0.5 V,扫描频率范围为0.1 Hz~100 kHz。
2 结果与讨论 2.1 器件制备及PPy/GO的修饰图 1所示为神经微电极阵列芯片的整体效果图和电极中心放大图。由图可知,遵循此流程制作出的电极阵列芯片引线清晰均匀,电极阵列表面无浮渣,选择比较好。这种直径20 μm、间距150μm的60通道神经微电极为高通量,长期无损检测神经网络、单细胞的神经电生理和递质电化学检测提供了可能[5, 17,18,19,20]。
 |
| 图1神经微电极阵列芯片 |
在60通道的神经微电极阵列上,选择5个神经微电极,使用不同电量密度,均成功地定向聚合生成PPy/GO,如图 2所示。图 2a为在0.3 C/cm2条件下的电镜扫描图,在氧化石墨烯的片层结构及表面的聚吡咯颗粒(球状纳米颗粒)均清晰可见。
 |
| 图2在平面微电极阵列上制备的聚吡咯氧化石墨烯 |
神经微电极阻抗的大小对于神经电生理检测有重要的意义,尤其是1kHz处的阻抗越小,越能够获得信噪比高的动作电位。这是因为神经信号动作电位的发放是毫秒级的,若在1 kHz左右的阻抗值很大,会导致有效的动作电位淹没在噪声中[11]。如图 3所示的数据表明,在使用0.3 C/cm2作为电聚合条件的神经微电极阻抗值(1 kHz)明显小于裸Pt电极。阻抗值从100 kW下降至7.94 kW,降幅达92.1%,对神经电生理信号和电化学信号的检测都具有重要的意义。
 |
| 图3裸铂电极和PPy/GO修饰的电极阻抗谱图 |
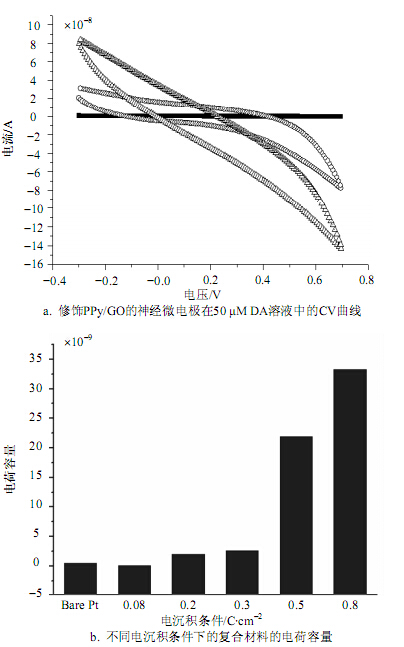
不同电量密度电聚合成的PPy/GO有不同的电化学性质。图 4a为修饰有PPy/GO的神经微电极在50 μM DA溶液中的伏安响应,其中包括裸Pt电极,使用0.3 C/cm2和0.8C/cm2 电量密度修饰的神经微电极的循环伏安曲线(CV曲线),Bare Pt—(■),0.3 C/cm2—(○),0.8 C/cm2—(△) ,分别为PPy/GO的电沉积条件。图 4b为不同电沉积条件下的复合材料的电荷容量。对于采用循环伏安法获得的CV曲线的电荷容量为:
| $Q = \frac{1}{v}\int_{{E_1}}^{{E_2}} I {\rm{d}}\varphi $ | (1) |
由图 4a可看出,对50 μM DA响应电流最高的是0.8 C/cm2,裸Pt电极响应很低。超微电极(直径微米级)表面的物质扩散由一维扩散转变为多维扩散,所得的电流在短时间内即能达到稳态,而且具有很大的电流密度。因此,超微电极的CV曲线为经典的Z形,无明显的氧化峰与还原峰[17,21]。0.8 C/cm2的聚合物氧化电流拐点出现在0.45 V,而0.3C/cm2的PPy/GO薄膜氧化电流拐点出现在0.38 V。氧化电压越小,能排除其他物质的干扰[8],则说明在0.3 C/cm2条件下生成的PPy/GO对DA的选择性好。此外,0.3 C/cm2的PPy/GO灵敏度相对于裸Pt电极也很高,综上所述,选择0.3 C/cm2为最佳的电聚合条件。
 |
| 图4最佳电沉积条件 |
本文采用MEMS工艺制作了60通道神经微电极阵列芯片,利用计时电压法在多通道神经微电极阵列上定向电聚合成PPy/GO复合材料,并通过循环伏安扫描法确定了最佳的电镀条件。在该条件下的微电极对DA响应灵敏度高,并拥有较低的阻抗值。本文提出的聚吡咯氧化石墨烯修饰的多通道神经微电极阵列,有望在神经双模信号(神经电化学信号和神经电生理信号)的检测中得到应用。
| [1] | KAREN C C, PHILIPPE R, Flexible polyimide microelectrode array for in vivo recordings and current source density analysis[J]. Biosensors and Bioelectronics, 2007, 22: 1783-1790. |
| [2] | WINDHORST U. 现代神经科学研究技术[M]. 赵志奇, 陈军 译. 北京: 科学出版社, 2006.WINDHORST U. Modern neurological research techniques [M]. Translated by ZHAO Zhi-qi, CHEN Jun. Beijing: Science Press, 2006. |
| [3] | STRONG T D, CANTOR H C, BROWN R B. A microelectrode array for real-time neurochemical and neuroelectrical recording in vitro[J]. Sensors and Actuators A, 2001, 91: 357-362. |
| [4] | SOKOLOFF P, GIROS B, MARTRES M P, et al. Molecular cloning and characterization of a novel dopamine receptor (D3) as a target for neuroleptics[J]. Nature, 1990, 347(13): 146-151. |
| [5] | SONG Yi-lin, LIN Nan-sen, LIU Chun-xiu, et al. A novel dual mode microelectrode array for neuroelectrical and neurochemical recording in vitro[J]. Biosensors and Bioelectronics, 2012, 38(1): 416-420. |
| [6] | JUDITH T C, AMADIO V, MART S. A novel method for monitoring surface membrane trafficking on hippocampal acute slice preparation[J]. Journal of Neuroscience Methods, 2003,125: 159-166. |
| [7] | BERGEN A V, PAPANIKOLAOU T. Long-term stimulation of mouse hippocampal slice culture on microelectrode array [J]. Brain Research Protocols, 2003, 11: 123-133. |
| [8] | KUMAR M, SWAMY B E K, SATHISH REDDY, et al. Synthesis of ZnO and its surfactant based electrode for the simultaneous detection of dopamine and ascorbic acid[J]. Anal Methods, 2013, 5(1): 735-740. |
| [9] | SATISH K, HARIT D, MOHAN S S, et al. Polymer communication fibers from polypropylene/nano carbon fiber composites[J]. Polymer, 2002, 43(5): 1701-1703. |
| [10] | RODGER C, FONG A J, LI W, et al. Flexibleparylene based multielectrode array technology for high-density neural stimulation and recording[J]. Sens Actuators B: Chem, 2008, 132(1): 449-460. |
| [11] | COGAN S F. Neural stimulation and recording electrodes[J]. Annu Rev Biomed, 2008, 10(56): 275-309. |
| [12] | GEIM A K. Graphene: Status and prospects[J]. Science, 2009, 324(5934): 1530-1534. |
| [13] | NOVOSELOV K S, GEIM A K, MOROZOV S V, et al. Two-dimensional gas of massless Dirac fermions in graphene[J]. Nature, 438: 197-200. |
| [14] | ZHOU Xiao-ming, LIAO Yu-hui, XING Da. Sensitive monitoring of RNA transcription levels using a graphene oxide fluorescence switch[J]. Chinese Science Bulletin, 2013, 58 (21): 2634-2639. |
| [15] | PROUT J O, DUPIN D, ARMES S P. Synthesis and characterization of polypyrrolecoated poly(methyl methacrylate) latex particles[J]. Journal Article J Mater Chem, 2009, 19: 1433-1442. |
| [16] | JIANG T, LIU C, XU S, et al. A novel planar microelectrode array fabricated for brain slice eleetrophysiology[C]//8th Annual IEEE International Conference on Nao/Micro Engineered and Molecular systems. [S.l.]: IEEE, 2013. |
| [17] | SYED B, LIU Xin, MATHAI J C, et al. Automated targeting of cells to electrochemical electrodes using a surface chemistry approach for the measurement of quantal exocytosis[J]. ACS Chemical Neuroscience, 2010, 1: 590-597. |
| [18] | YUAN Fang, GAO Xiao-hui, SANJU G, et al. Magnetron sputtered diamond-like carbon microelectrodes for on-chip measurement of quantal catecholamine release from cells[J]. Biomed Microdevices, 2008, 10: 623-629. |
| [19] | CHRISTER S, ARTO H, JENNY A, et al. On-chip determination of dopamine exocytosis using mercaptopropionic acid modified microelectrodes[J]. Electroanalysis, 2007, 19(2-3): 263-271. |
| [20] | CHRISTER S, ARTO H, SIMON P, et al. Fully automated microchip system for the detection of quantal exocytosis from single and small ensembles of cells[J]. Lab Chip, 2008, 8: 323-329. |
| [21] | 张祖训. 超微电极电化学[M]. 北京: 科学出版社, 1998. ZHANG Zu-xun. Ultra microelectrode electrochemistry [M]. Beijing: Science Press, 1998. |
 2015, Vol. 44
2015, Vol. 44
