2. 中国科学院大学电子电气与通信工程学院 北京 石景山区 100049
2. School of Electronic, Electrical Communication Engineering, University of Chinese Academy of Sciences Shijingshan Beijing 100049
随着社会进步和科学技术的发展,早期严重威胁人类健康的孕产期疾病、传染性疾病的危害范围和程度有了明显的下降,而包括神经性疾病在内的各种慢性病已成为现代人类健康的主要威胁[1]。神经元是构成神经系统的基本单元,大脑包括数十亿个神经元和多种感官信息传递机制,通过神经元群体密切协调活动控制人或动物的思维和行为[2, 3, 4]。神经元间进行神经信息传递有脉冲放电和神经递质释放两种基本方式。神经元的放电活动和信息编码过程在神经系统中起着重要的基本作用,同时神经递质通过传递各种信息而实现调节机体生理功能的作用,并与多种功能性疾病和病变息息相关[5, 6, 7, 8, 9]。当神经细胞产生功能障碍时,神经递质将会失调,神经异常放电,引起神经性疾病的发生[10, 11]。因此,开展神经电生理和神经递质电化学双模检测研究,对于神经生理学、神经性疾病的发病机理、神经性疾病的预防和诊治等研究具有重要的科学意义[12]。
目前,进行神经信息检测研究的仪器多为单模检测仪器。开展神经电生理研究多采用神经微电极阵列及多通道神经电生理记录仪,该类仪器和配套电极的技术被德国Multichannel Systems公司、美国的Plexon、Cyberkinetics、Blackrock公司垄断。德国Multichannel Systems公司研发的微电极阵列细胞外电生理信号记录仪,有16通道及64通道。美国Blackrock公司的128通道神经信息记录仪能够实现128通道神经电生理信号的实时记录与处理。这些国外多通道神经电生理记录仪价格较为昂贵。神经递质电化学检测多采用电化学工作站。亟需研制能够同时实现多通道的神经电生理信号和神经递质化学信号双模检测的仪器。
本文针对神经科学基础研究对神经信息双模检测仪器的迫切需求,开展了双模态多通道神经信息检测分析仪器的研制,以此实现多通道神经信息双模检测。
1 系统设计双模态神经信息检测仪由中央控制模块、电生理检测模块、电化学检测模块、数据采集模块及多通道神经信息分析处理软件组成,其设计框图如图 1所示。中央控制模块采用基于ARM核的STF32M103作为核心微处理器。STF32M103是一款低功耗芯片,具有睡眠、停机和待机模式;具有最高72 MHz的工作频率,满足高速数据处理的要求;该芯片具有丰富的外围接口,为其他各模块提供控制信号。
 |
| 图1系统设计框图 |
128通道电生理检测模块分为4组32通道电生理检测单元实现多通道神经信息检测。电生理信号非常微弱,幅度为10~500 μV。微电极阵列的尺寸在微米量级,其阻抗较高,约在兆欧量级,高阻抗的微弱电极阵列不利于微弱电生理信号的检测。因此,设计HeadStage实现阻抗的转变,将高阻抗信号转换为低阻抗信号,利于检测。该HeadStage由AD8674来实现。AD8674是一款高精密的运算放大器,利用其输入阻抗极大、输出阻抗极小的特点从而实现阻抗转换。电生理信号的频率范围为0.1 Hz~1kHz,对电生理信号进行两级放大及带通滤波,将微弱的微伏级电生理信号放大为毫伏级信号,并且0.1~
3 000 Hz的带通滤波器滤除了高频噪声和直流低频噪声。电生理检测模块的电位分辨率为0.3 µV。
1.2 电化学检测模块神经递质是神经系统中进行神经信息传导的化学物质,多巴胺、抗坏血酸(ascorbic acid,AA)、5-羟色胺、乙酰胆碱等神经递质在神经信息传导中起着重要的作用,具有重要的研究意义。本文设计8个独立的电化学检测通道,可实现对不同神经递质电化学信号的检测。由于神经递质的浓度非常低,属于nM至μM量级,其电化学反应响应电流也较低,属于pA至nA量级。采用芯片LMP7721实现电流-电压转换,完成电化学电流检测。LMP7721是一块具有极低偏置电流的高精度运算放大器,其偏置电流仅为3 pA,适合进行极微弱电流检测。对于8个独立的电化学检测通道,取样电阻的值可设置成不同的电阻值以满足不同检测精度的需求,本文对仪表电化学电流检测的精度可达pA级。电化学检测模块可分别实现循环伏安法和计时电流法进行神经递质电化学信号检测。
1.3 信号采集模块神经电信号的高频信号可以达kHz,因此需要采用高速的多通道信号采集部件对神经信号进行采集,以保证神经信息不丢失。本文采用两块NI的USB-6255完成对128通道电生理信号和8通道电化学信号的高速采集。NI USB-6255具有80路16位模拟信号输入,单通道采样率可达1.25 MS/s。该仪表每块USB-6255能够完成对64通道电生理信号和4通道电化学信号的采集,当各个通道同时进行采集时,采集速率为14 kS/s,能够满足电生理信号和电化学信号高速采集的需求。信号采集模块通过USB与PC机进行通信。
1.4多通道神经信息处理软件信号采集模块将电生理和电化学信号传输给PC机,通过多通道神经信息处理软件实现信号的获取与处理。该软件分为数据处理、数据显示和其他通用功能。数据处理功能模块实现以下功能:128通道电生理信号差分处理、滤波、Spike分离、Spike分类、场电位提取;配置电化学检测参数;电生理、电化学双模信号同步记录、标记和储存。数据显示功能模块实现128通道电生理信号动作电位、场电位信号显示及8通道电化学I-T、C-V曲线显示。其他通用功能包括文件新建、打开、关闭、保存、帮助等功能。
2 实验方法 2.1 材料和试剂电生理信号检测用模拟神经信号发生器(美国Blackrock公司),64通道离体微电极阵列(实验室自制),PBS(10 mmol/L,pH=7.4,Sigma公司),抗坏血酸(Sigma公司)。所用水为去离子水。
2.2 神经电生理信号检测将模拟神经信号发生器作为信号源,采用研制的仪器对该信号进行多通道实时检测。模拟神经信号发生器能够产生128通道的模拟神经信号,Spike信号的幅值为微伏级,适用于对仪器进行电生理信号性能检测。
2.3 神经递质电化学信号检测采用循环伏安法实现神经递质电化学信号检测。分别配制0、1、2、5 mmol/L等不同浓度的抗坏血酸溶液,工作电极采用修饰有氮化钛(TiN)的铂金微电极阵列(Pt),对电极采用Pt电极,Ag/AgCl为参比电极,采用循环伏安法分别对不同浓度的抗坏血酸溶液进行扫描。
3 实验结果与讨论 3.1 神经电生理信号检测结果测得的128通道神经电生理信号如图 2所示,图 2a左侧为进行高通滤波后的实时动作电位信号,图 2a右侧为提取的128通道Spike信号;图 2b左侧上部分为提取的单通道Spike信号,下部分为场电位信号,右侧为进行Spike信号分类的结果。该仪器能够对128通道的微弱神经电生理信号进行实时检测,采用截止频率为750 Hz的高通滤波器滤波信号可得动作电位信号,采用截止频率为400 Hz的低通滤波器可以得到场电位信号。采用检测阈值的方法可以提取Spike信号,Spike信号的峰-峰值为320 µV,信噪比为7.5。采用商用的Cerebus多通道神经电生理信号记录系统测得的模拟信号发生器产生的Spike信号峰-峰值为331.50 µV[13]。相比商用的Cerebus多通道神经电生理信号记录系统,本文研制的多通道双模态检测仪器对电生理信号检测的准确度为96.53%。
3.2 神经递质电化学信号检测结果本文测得的不同浓度抗坏血酸溶液的循环伏安曲线如图 3所示。结果表明,在工作电压为300~
500 mV之间能较好地分辨出不同浓度抗坏血酸的梯度,因而选取400 mV作为进行抗坏血酸神经递质电化学检测的工作电压。图 4为工作电压为400mV下,检测仪器对不同浓度(0、1、2、5 mol/L)的抗坏血酸溶液响应电流曲线。由图可知,检测仪器对不同浓度的抗坏血酸溶液的响应电流呈良好的线性关系,灵敏度为6.084 nA/(mmol/L),线性相关系数为0.970。图 3和图 4表明该检测仪能够实现对神经递质电化学信号的灵敏检测。
 |
| 图2128通道模拟神经信号检测结果 |
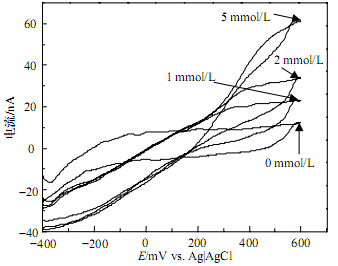 |
| 图3微电极在不同浓度抗坏血酸溶液中的循环伏安曲线 |
 |
| 图4检测仪器对不同浓度的抗坏血酸溶液响应电流曲线 |
本文研制了多通道双模态神经信息检测分析仪,该检测分析仪能够实现对128通道神经电生理信号和8通道神经电化学信号进行检测。该检测分析仪主要由中央控制模块、电生理检测模块、电化学检测模块、数据采集模块及多通道神经信息分析处理软件组成。采用阻抗转换、两级放大及带通滤波的方式实现微伏级微弱电生理信号检测;设计高精度的电流-电压转化及放大电路实现微弱电化学信号的检测。目前在神经信息检测方面,只有单一模式的检测分析仪器,如用于神经电信号检测研究的电生理记录仪或用于递质化学信号检测研究的电化学工作站,缺少神经电生理和递质化学双模同步实时检测的设备和手段。单一模式检测设备获取神经信息量不完整,其检测的实时性及综合性有待提高,无法充分满足神经信息相关研究和检测的需求,故对相关神经电信号和递质信号进行双模同步检测的仪器系统研制具有显著的创新性。本文将神经电生理信号检测和神经电化学信号检测系统集成,采用同一电源管理,去除了双模态信号检测中基准电压差间的干扰;采用同一时钟源进行双模神经信号控制,能够实现双模信号实时同步检测;从而有效地实现神经信息多通道双模实时检测。采用研制的仪器进行电生理检测,能够采集分离128通道的动作电位信号和场电位信号,采用阈值提取的方式能够有效地提取Spike动作电位,Spike信号的峰-峰值为
320 µV,与商用的Cerebus多通道神经电生理信号记录系统对比,该检测分析仪对神经电生理信号的检测准确度为96.53%。采用64通道的离体微电极阵列作为工作电极对不同浓度的抗坏血酸溶液进行电化学循环伏安法扫描,在工作电压为300~500mV之间能够较好地分辨出不同浓度的抗坏血酸的梯度。工作电压为400 mV下,仪器对不同浓度的抗坏血酸溶液电流响应灵敏度为6.084nA/(mmol/L)。实验结果表明,该检测分析仪不仅能够实时检测、分析处理128通道神经电生理信号,而且能够实现神经递质高灵敏度电化学检测,为神经信息双模检测奠定了技术基础。下步的研究工作将会是应用该神经信息检测分析仪器,结合实验室自制的微电极阵列,开展神经电生理和电化学信号双模同步检测研究。该检测分析仪将在神经疾病预防和诊治、神经网络、神经生理学、神经心理学等基础科学研究方面具有重要的科学意义和广泛应用前景。
| [1] | 中国科学院人口健康领域战略研究组. 中国至2050年人口健康科技发展路线图[M]. 北京: 科学出版社, 2009.Chinese academy of sciences research group in health field. The development roadmap of science and technology till 2050 in health field[M]. Beijing: Science Press, 2009. |
| [2] | BUZSAKI G. Large-scale recording of neuronal ensembles[J]. Nature Neuroscience, 2004, 7(5): 446-451. |
| [3] | JOHN K C. Using multi-neuron population recordings for neural prosthetics[J]. Nature Neuroscience, 2004, 7(5): 452- 455. |
| [4] | SCANZIANI M, HAUSSER M. Electrophysiology in the age of light[J]. Nature, 2009, 461(7266): 930-939. |
| [5] | CARVEY P M, PUNATI A, NEWMAN M B. Progressive dopamine neuron loss in parkinson's disease: the multiple hit hypothesis[J]. Cell Transplantation, 2006, 15(3): 239-250. |
| [6] | MATTHEW D J, ROBERT K F, MATTHEW D G. Implantable microelectrode arrays for simultaneous electrophysiological and neurochemical recordings[J]. Journal of Neuroscience Methods, 2008,174: 62-70. |
| [7] | POLONA P, MATEJ P, JANEZ R, et al. A chamber for biomechanical, electrochemical and electrophysiological measurements in functional segments of peripheral nerves[J]. Measurement, 2013, 46: 654-659. |
| [8] | MICHAEL A J. In vivo electrochemical measurements: Past, present and future[J]. Bioanalysis, 2013, 5(2): 119-122. |
| [9] | ELISA C, ALBERTO A, EMMA M, et al. Electrochemical and electrophysiological performance of carbon nanotube based coatings on neural probes[C]//220th ECS Meeting. [S.l.]: The Electrochemical Society, 2011. |
| [10] | CHEER J F, HEIEN M L, GARRIS P A, et al. Simultaneous dopamine and single-unit recordings reveal accumbens GABAergic responses: implications for intracranial self-stimulation[J]. Proc Natl Acad Sci USA, 2005, 102: 19150-5. |
| [11] | BICKFORD-WIMER P, PANG K, ROSE G M, et al. Electrically evoked release of norepinephrine in the rat cerebellum: an in vivo electrochemical and electrophysiological study[J]. Brain Res, 1991, 558: 305-311. |
| [12] | SONG Yi-lin, LIN Nan-sen, CAI Xin-xia, et al. A novel dual mode microelectrode array for neuroelectrical and neurochemical recording in vitro[J]. Biosensors and Bioelectronics, 2012, 38: 416-420. |
| [13] |
Blackrock microsystems. Cerebus neural signal processing system[EB/OL]. [2011-05-23]. http://www. blackrockmicro. com/blackrockmicro/userfiles/file/Cerebus%20Manual. |
 2015, Vol. 44
2015, Vol. 44
