-
电峰值电场强度从10~300 kV/cm的纳秒脉冲电场可以单独应用于肿瘤消融研究[1]。由于脉冲宽度低于细胞膜的充电周期,纳秒脉冲电场可以与细胞内的细胞器相互作用。通过选择合适的脉冲参数,纳秒脉冲可以触发肿瘤细胞凋亡,进而诱导特异性免疫,不仅可以进行局部肿瘤消融,而且可以有效防治肿瘤转移和复发[2-5]。纳秒脉冲电场的凋亡机制研究包括电场作用靶点和信号通路,电场作用靶点的探究有助于优化出最佳的脉冲参数以获得最佳的治疗效果[6-7],而信号通路的研究为增强/抑制特定的分子开发新的治疗方案。文献[8-11]分别说明了纳秒脉冲诱导肿瘤凋亡涉及p53凋亡通路、TGF-b1通路、PI3K/AKT通路、和NF-κB通路等。然而由于纳秒脉冲诱导肿瘤凋亡涉及的靶点较多,也受传统研究方法的限制,纳秒脉冲诱导肿瘤凋亡的凋亡机制尚未得到充分研究。
蛋白芯片是在载体表面有序排列的大量蛋白抗体,相较于酶联免疫吸附试验(ELISA)和免疫印迹实验(WB)这种只能检测单种蛋白的技术,蛋白芯片可以同时检测多个蛋白。低密度蛋白芯片可以同时观测多个目标蛋白,而高密度蛋白芯片可以同时观测数以百计的蛋白质[12]。此外,蛋白芯片不仅可以快速筛选关键蛋白,还可以通过富集分析来发现它们之间的相关关系和未发现的机制。富集分析是一种针对高通量组学数据的分析手段,该分析手段基于基因集,而不是单个基因,可以快速分析基因表达[13]。纳秒脉冲诱导肿瘤凋亡的作用机制复杂,而且涉及多个靶点,因此抗体阵列和高通量蛋白组学富集分析是本研究以及类似的多靶点机制研究的高效研究方案。
本研究首先通过基于流式细胞荧光分选技术的凋亡实验,观察在脉冲电场作用小鼠黑色素瘤B16细胞后不同孵育时间的凋亡率,从而间接观察脉冲电场作用细胞后的细胞凋亡过程。然后,通过蛋白芯片实验显示脉冲电场作用B16细胞后不同蛋白的差异表达,并根据GO功能富集分析和KEGG通路富集分析,分析出纳秒脉冲诱导治疗的生物学过程、分子生物学过程和相关的KEGG通路。纳秒脉冲电场刺激小鼠黑色素瘤B16细胞的凋亡通路分3个步骤,而且涉及多个信号通路,如PI3K/AKT通路、NF-κB通路、TGF-b1细胞凋亡通路、肿瘤坏死因子通路和p53凋亡通路。基于蛋白芯片技术与富集分析的实验方案在多靶点机制研究中具有独特的优势,这些实验结果为设计未来的纳秒脉冲诱导治疗方案提供了参考,优化最佳的脉冲参数或增强/抑制特定的分子以获得最佳治疗效果。
-
小鼠黑色素瘤B16细胞株购自Procell生物科技有限公司,购买后一直使用液氮冷冻保存至实验前。复苏时在37 ℃的热水浴中进行解冻,然后转移到RPMI-1640的培养基中。RPMI-1640培养基中加入10%的胎牛血清(FBS)和2%的青霉素−链霉素溶液。培养瓶被置于37 °C、5% CO2、95%空气的培养箱中培养。
-
小鼠黑色素瘤B16细胞首先被消化后,制成细胞悬浮液,其细胞浓度为3×106 cell/ml。然后,取40 μL细胞悬浮液加载到电极杯中(购置于Bio-Rad laboratories),该电极杯的间隙为1 mm。将加载好的电极杯装载在安全操作池中(购置于Bio-Rad laboratories),将整个安全操作池作为生物负载与自研的数控高压纳秒脉冲发生器的输出端相连。
数控高压纳秒脉冲发生器是基于光耦隔离控制系统和高压SiC MOSFET开关阵列,可以整体上分为8个部分,其PC控制系统、高压直流电源模块控制、脉冲检测模块与生物负载接口均为外加设备,其余为核心电路部分。8个模块的关系如下:PC控制系统控制低压信号发生模块产生所需的低压脉冲序列驱动光耦驱动模块;光耦驱动模块控制高速开关模块驱动高压储能模块向生物负载接口输出指定脉冲序列;脉冲序列的幅值由高压直流电源模块控制,该模块可以由PC控制系统调控;脉冲检测模块可以将生物负载接口处的脉冲序列反馈给PC控制系统。该低压数字信号发生器由单片机(Digilent BASYS2 FPGA)和高速驱动器(Microchip Technology Inc.的MCP14E9)组成的,由PC上的ISE design suite 14.1中编写和调试的VHDL程序控制。光耦隔离电路是由低压数字信号发生器控制的并行运行的FOD3180芯片。储能元件一端连接高压直流电源和SiC MOSFET开关阵列,另一端连接生物负载[14]。
数控高压纳秒脉冲发生器施加的纳秒脉冲重复频率为2 Hz;峰值脉冲电场为16 kV/cm;脉冲宽度500 ns;脉冲数目为120。流式细胞分选的实验变量为纳秒脉冲电场作用后的孵育时间,分别是0、2、4、6、16和24 h;蛋白芯片的实验变量为纳秒脉冲电场作用后的孵育时间,分别是0、4和16 h。每个实验变量有3个实验样本。由于输出脉冲电场的低重复频率、较好的散热性和培养基较高的比热容,细胞没有热积累。
-
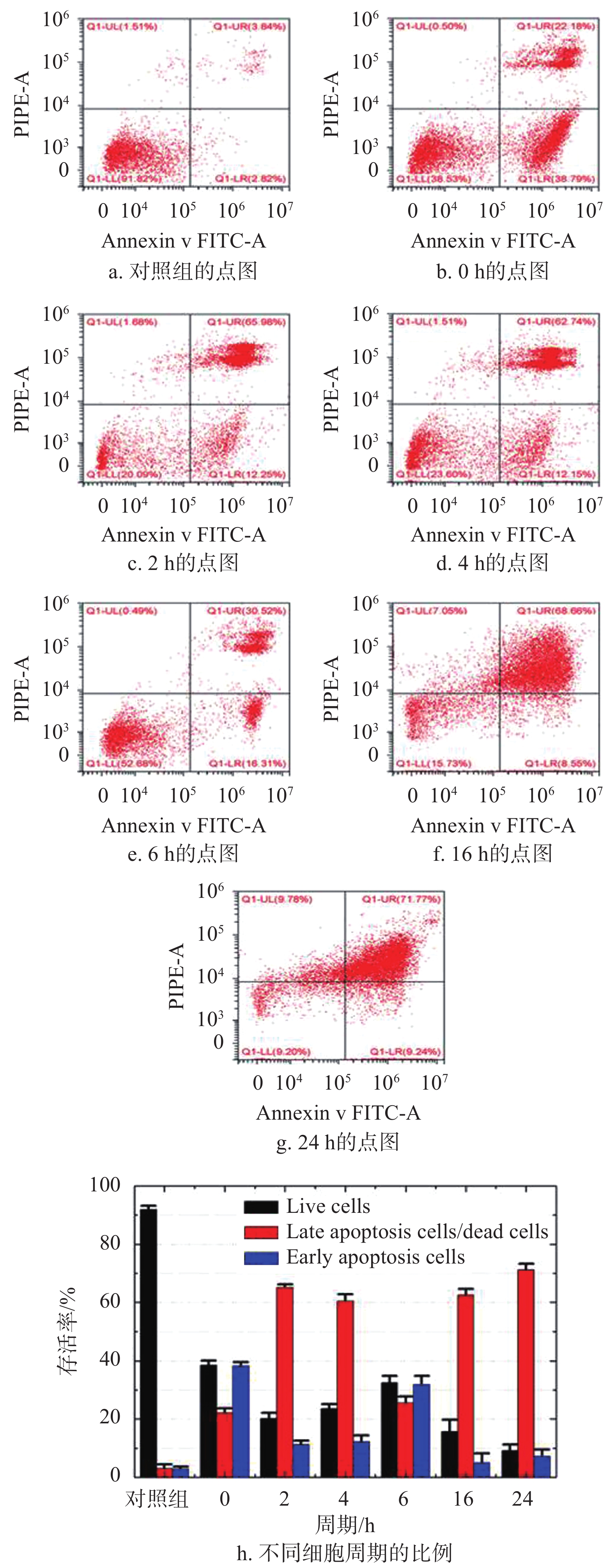
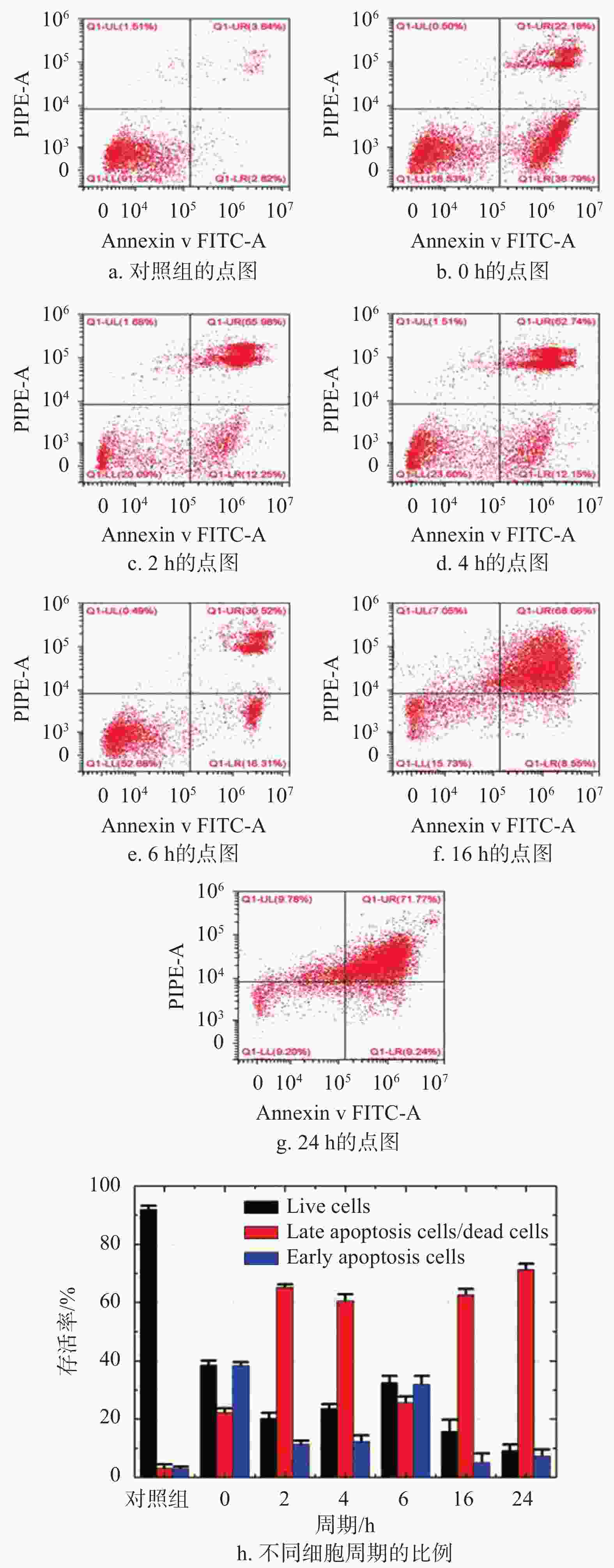
流式细胞荧光分选技术是一个快速的定量分析单个细胞多种特征的细胞检测技术。在应用荧光激活细胞分选技术时,细胞悬浮液中的细胞呈单列依次通过,并由不同波长的激光照射,数千个细胞在几秒钟内被逐一分析。这些细胞发出荧光和散射光,经检测、过滤并转换成数据存储在计算机。被分选的细胞数量与从单个细胞发射或散射的光通量成正比。本实验通过4个不同的参数对强场纳秒脉冲电场作用之前和之后的细胞同时进行评估。每次实验先将1.2×105个细胞用强场纳秒脉冲电场处理,再将细胞悬浮液离心,再与荧光标记物(AnnexinV-FITC和Propidiumiodide (PI))混合,以确定凋亡细胞的比例。流式细胞术检测实验使用的检测设备是Beckman流式细胞仪,使用488 nm氩激光进行激励,通过确定细胞在正向散射和侧向散射等值线图上的位置,对每个样品的细胞进行分析。使用干涉带通滤波器集(FL-1)和(FL-2)收集发射的荧光光通量。最后,实验数据通过Cytoflex软件进行存储和分析,实验结果如图1所示。
-
蛋白芯片是将大量不同的蛋白质抗体有序地排列、固定于固相载体表面,形成微阵列。利用抗原抗体特异性结合的原理,实现对生物蛋白质分子精准、快速、多因子、高通量的检测。本实验使用的是购自美国RayBiotech公司的AAM-APOSIG-1蛋白芯片。该试剂盒在细胞培养悬浮液中同时检测出17种可溶性蛋白,包括AKT、ATM、caspase-3、caspase-7、CHK1、elF2a、ERK1/2、Hsp27、IκBα、JNK、NF-κB、p27、p38、p53、Smad2和TAK1;还包括POS和NEG,POS是阳性对照点,其数据用于数据归一化,NEG是阴性对照点,其数据用于数据去基线。用荧光图像分析仪Las-1000进行检测,用Las-1000 Image Reader软件进行数据读写。
-
蛋白芯片的各个蛋白的荧光数据使用POS和NEG的数据进行归一化,使用R/Bioconductor的moderated t-statistics程序包进行统计学分析,设置P值0.05以下,fold changes大于1.2为有统计学意义。对照组与4 h组有统计学意义区别的靶蛋白点信号密度变化,如图2a所示。
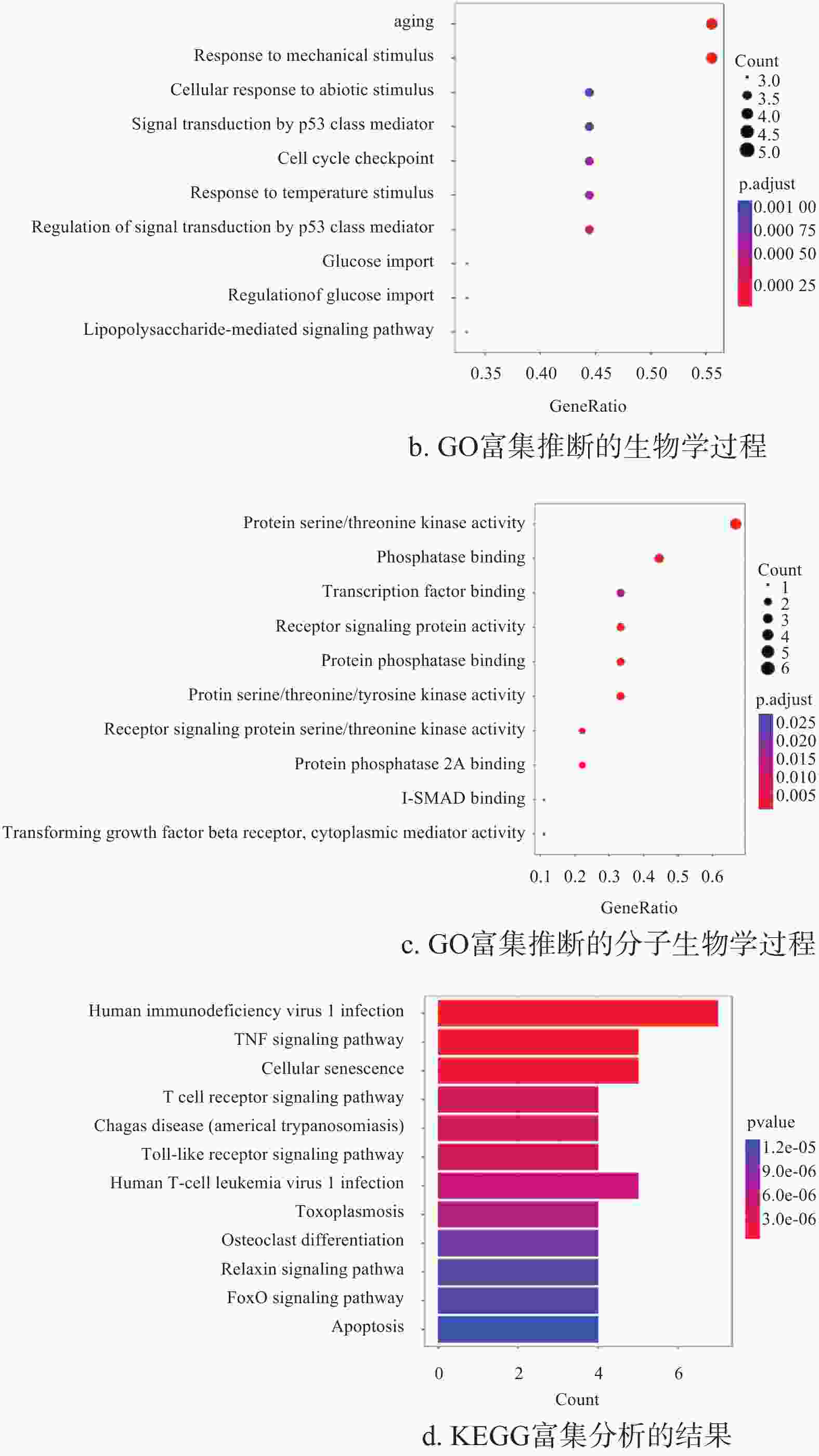
采用R/Bioconductor的cluster profiler进行GO基因富集分析和KEGG基因富集分析。对于GO基因富集分析,设置P值0.05以下,count大于2为有统计学意义,其中count定义为某一项中差异表达蛋白的数量,富集因子定义为count除以差异表达蛋白的总数。按照count值的降序排列,生物过程和分子功能的前10个结果如图2b和图2c所示。对于KEGG基因富集分析,设置P值0.05以下,count大于2为有统计学意义,其中count定义为某一通路中差异表达蛋白的数量。按调整P值的升序排列,凋亡通路前10个结果如图2d所示。
-
图1可以间接揭示强场纳秒脉冲电场诱导小鼠黑色素瘤B16细胞的细胞凋亡过程。图1a~1g是流式实验的原始数据示例,其展示了细胞实验的细胞分选标准。图1 h为未经处理的肿瘤细胞的表达和治疗组不同细胞周期的柱状图,其中黑色柱为活细胞的细胞比例,红色柱为晚期凋亡细胞/死细胞和蓝色柱为早期凋亡细胞。图中黑色柱的数据展示了对照组的存活率远高于治疗组(p<0.05)。治疗组在2~6 h之间,存活率随孵育时间的延长而增加,这是由于细胞快速增殖所致;相反,在0~2 h和6~24 h这两个时间段内,存活率随着孵育时间的延长,细胞存活率下降,说明强场纳秒脉冲电场引起的细胞凋亡是一个过程,不是瞬间事件。由红色柱和蓝色柱的数据可知,治疗组相较对照组有明显的细胞凋亡,包括晚期细胞凋亡和早期细胞凋亡(p<0.05)。对于治疗组,早期细胞凋亡的趋势类似于存活率;晚期凋亡和死亡比例的趋势与存活率的相反。以上趋势表明,细胞凋亡是肿瘤细胞在施加脉冲后立即触发,之后可能收到凋亡信号,然后凋亡调节分子相互作用,激活级联caspases凋亡。这些现象表明强场纳秒脉冲电场可能通过内源性和外源性途径触发小鼠B16黑色素瘤细胞凋亡[15-16],其作用机制有待于蛋白芯片进一步研究。
-
图2a显示了对照组与4 h组有统计学意义区别的靶蛋白点信号密度变化,包括AKT、ATM、Caspase-3、Caspase-7、CHK1、IκBα、p38、p53、SMAD2、TAK1。根据这些数据,可以快速进行富集分析。
图2b显示,强场纳秒脉冲电场刺激癌细胞的生物学过程,其中老化(aging)、机械刺激反应(response to mechanical stimulus)、对非生物刺激的反应(cellular response to abiotic stimulus)、p53的信号转导(signal transduction by p53 class mediator),和细胞周期检查点(cell cycle checkpoint)的作用最为显著。p53的信号转导是其中最重要的生物学过程,其中涉及NF-κB信号通路,p53信号通路等多个信号通路。根据文献[8]和[17]的针对HCT 116细胞(p53–/–和p53+/+)的纳秒脉冲诱导治疗的活体动物实验表明,其凋亡过程的后端caspase激活存在前馈作用,在p53的调节下Cyt-C和Bax快速上升。
生物衰老作为生物的固有特征,是一个复杂的过程,涉及炎症(inflammation)、免疫衰老(immune aging)和衰老(senescence)3个因素[18]。文献[19]表明,几种肿瘤抑制因子和细胞周期抑制剂可以引发衰老。端粒缩短是衰老的一个显著标志,文献[20]报道这个过程在强场纳秒脉冲电场刺激后的癌细胞中发现,并由p53通路调节。
机械刺激反应主要涉及局灶性粘附激酶(FAK)、phosphoinositide 3激酶和Rho/Rho激酶的表达[21]。目前的基于基因芯片的研究表明,细胞对纳秒脉冲电场的反应包括多种机械刺激反应,其中前20个对应基因中有50%位于两个不同的细胞位置,分别是细胞膜和核核膜[22]。机械/非生物刺激的响应可能来源于脉冲电场作用于极性膜上的洛伦兹力,也可能来源于通透性改变引起的离子浓度的变化[23]。
细胞周期检查点控制细胞DNA合成、增殖和生长停滞、DNA修复或凋亡时间,其在某些癌症的诊断和治疗中具有临床意义。文献[24-26]表明,纳秒脉冲电场诱发的细胞周期检查点主要在于DNA损伤和DNA表达,其主要受p53的影响。
图2c是纳秒脉冲电场刺激肿瘤细胞的生物学过程,其中最重要的是蛋白质的丝氨酸/苏氨酸/酪氨酸激酶活性(protein serine/threonine/tyrosine kinase activity)、磷酸酶结合(phosphatase binding)、转录因子结合(transcription factor binding)、受体信号蛋白的活性(receptor signaling protein activity)和蛋白质磷酸酶结合(protein phosphatase binding)。文献[9]和文献[27-28]发现纳秒脉冲诱导细胞凋亡涉及包括AMPK磷酸化、TNF-α活动和TGF-β活动等。
图2d是纳秒脉冲电场刺激肿瘤细胞的KEGG通路富集分析结果,其中涉及PI3K/AKT通路、NF-κB 通路、TGF-b1通路、TNF通路、和p53通路。文献[10]指出联合使用纳秒脉冲电场与mTOR抑制剂,增强PI3K/AKT通路,通过增强Bax和抑制Bcl-2,诱导caspase依赖性凋亡。文献[11]指出,纳秒脉冲电场通过NF-κB通路调节,抑制细胞周期蛋白的表达和阻碍G1细胞周期,来抑制肿瘤生长。文献[29]指出基于ELISA检测的活体实验,发现纳秒脉冲作用后,TNF-α和IL-2表达增强,IL-2表达下降。由上可知,PI3K/AKT通路、p53通路和NF-κB通路等在纳秒脉冲诱导中起主要作用[8-11]。
-
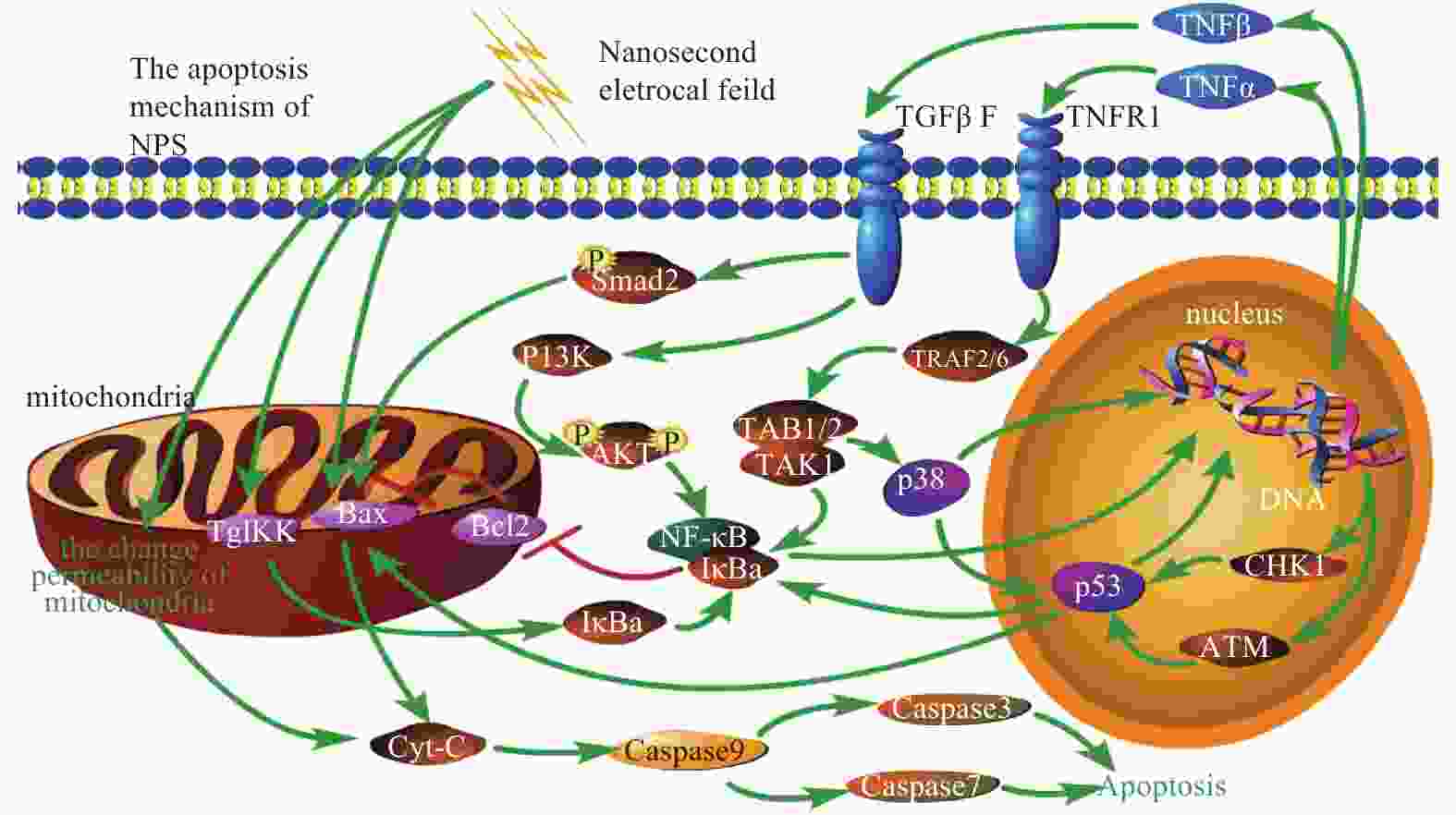
依据以上结果和文献可以总结纳秒脉冲电场诱导肿瘤细胞凋亡的通路,如图3所示,一共包括3步:1)纳秒脉冲电场改变线粒体的通透性,从而TgIKK和BAX的表达,导致Caspase细胞凋亡和通过NF-κB途径的DNA损伤;2)TNF-α凋亡通路和p53通路是由DNA损伤激活的;3)基于p53和TGFβ的调制,TGF-b1凋亡通路被激活。这些结果表明,纳秒脉冲电场的作用机制涉及多种凋亡途径和分子,通过增强或抑制特定蛋白的表达以获得最佳疗效。根据纳秒电场在细胞分布的原则[14]和线粒体在纳秒脉冲电场诱导凋亡中的决定作用,纳秒脉冲电场的脉冲宽度在100 ns~1 μs中优化,确保纳秒电场集中在细胞质中。
在临床应用中,纳秒脉冲电场的作用机制还可能涉及特异性免疫机制、微环境改变等。文献[30]指出纳秒脉冲电场可以破坏毛细血管,干扰实体瘤的微环境。文献[31]指出纳秒脉冲电场可以激活特异性和记忆性免疫,涉及CD8+细胞和CD314细胞的表达。对于相关的细胞因子免疫机制,也可以通过本文类似的研究方案进行研究。值得注意的是,利用基因芯片也可以全面快速地分析基因表达[32]。然而,几乎所有的细胞功能都是由蛋白质执行的,不能简单地通过DNA和RNA技术来研究。文献[33]清楚表明,mRNA的相对表达水平与相应的蛋白存在差异。因此,本文类似利用蛋白芯片的研究方案对探索新的细胞凋亡和免疫机制具有重要意义。
-
纳秒脉冲电场诱导小鼠黑色素瘤B16凋亡的通路涉及诸多内源性和外源性的凋亡通路,包括PI3K/AKT通路、NF-κB通路、TGF-β通路、TNF通路和p53通路。纳秒脉冲电场诱导治疗是一种很好潜在的免疫疗法,并可以通过增强或抑制特定蛋白的表达以获得最佳疗效。同时,通过把脉冲电场集中在线粒体上,也可以改善相关疗法的效果。基于蛋白芯片技术和富集分析的研究方法在多靶点机制研究中具有独特优势。
Study on the Apoptosis Mechanism of Murine Melanoma B16 Cells Stimulated by Nanosecond Pulse Electric Field
-
摘要: 纳秒脉冲电场具有诱导癌细胞凋亡、抑制肿瘤生长和诱导抗肿瘤免疫的作用。由于纳秒脉冲诱导治疗涉及的通路过多和常规检测特异性生物标志物技术的局限性,其凋亡机制尚未达成共识且暂时没有高效的研究方法。为了深入研究凋亡机制,该文利用蛋白芯片技术和富集分析技术研究了纳秒脉冲电场诱导小鼠黑色素瘤B16细胞的凋亡机制,并推导了纳秒脉冲诱导治疗的凋亡机制。该研究方法对于有此类靶点数目众多的机制研究具有独特的优势,可为设计未来的纳秒脉冲诱导治疗方案提供参考,优化最佳的脉冲参数或增强/抑制特定的分子以获得最佳治疗效果。Abstract: Nanosecond pulsed electric field (nsPEF) has been demonstrated to induce cancerous cell apoptosis, inhibit tumor growth and elicit antitumor immunity. Caused by the apoptosis mechanism of nanosecond pulse stimulation (NPS) therapy involving too many targets and the limitation of conventional detecting specific biomarker technology, the apoptosis mechanism of NPS has not been reached consensus and there is no efficient method for researching it. In order to gain further insight into the apoptosis mechanism, the paper has studied the murine melanoma B16 cells stimulated by nsPEF by using antibody array. A hypothesis for the pathway of NPS with three steps for the apoptosis mechanism was introduced. The research method possess the unique advantages in this kind of researches with huge number of targets, the obtained results could be helpful for designing future NPS therapies and aid in targeting the specific molecules with the optimal pulse parameters to obtain best therapeutic effect.
-
Key words:
- antibody array /
- apoptosis /
- enrichment analysis /
- nanosecond pulsed electric field
-
[1] NUCCITELLI R, PLIQUETT U, CHEN X H, et al. Nanosecond pulsed electric fields cause melanomas to self-destruct[J]. Biochem Bioph Res Co, 2006, 343: 351-360. doi: 10.1016/j.bbrc.2006.02.181 [2] MARI O G, NISO S M, BAEHRECKE E H, et al. Self-consumption: The interplay of autophagy and apoptosis[J]. Nature Reviews Molecular Cell Biology, 2014, 15: 81-94. [3] NUCCITELLI R, MCDANIEL A, ANAND S, et al. Nano-Pulse stimulation is a physical modality that can trigger immunogenic tumor cell death[J]. J Immunothercancer, 2017, 5: 32-34. [4] GUO S, JING Y, BRCNS N I, et al. Nano-Pulse stimulation induces potent Immune responses, eradicating local breast cancer while reducing distant metastases[J]. Int J Cancer, 2017, 142: 629-640. [5] ALESSANDRA R, OLGA N P, PETER A M, et al. Nanosecond pulsed electric fields induce endoplasmic reticulum stress accompanied by immunogenic cell death in murine models of lymphoma and colorectal cancer[J]. Cancers, 2019, 11: 2034. [6] NAPOTNIK T B, WU Y H, GUNDERSEN M A, et al. Nanosecond electric pulses cause mitochondrial membrane permeabilization in jurkat cells[J]. Bioelectromagnetics, 2012, 33: 257-264. doi: 10.1002/bem.20707 [7] FORD W E, REN W, BLACKMORE P F, et al. Nanosecond pulsed electric fields stimulate apoptosis without release of pro-apoptotic factors from mitochondria in B16f10melanoma[J]. Arch Biochem Biophys, 2010, 497: 82-89. [8] HALL E H, SCHOENBACH K H, BEEBE S J. Nanosecond pulsed electric fields induce apoptosis in p53-wildtype and p53-null HCT116 colon carcinoma cells[J]. Apoptosis, 2007, 12: 1721-1731. doi: 10.1007/s10495-007-0083-7 [9] SUNG C K, YIM H, ANDREWS E, et al. A mouse polyomavirus-encoded microRNA targets the cellular apoptosis pathway through Smad2 inhibition[J]. Virology, 2014(468-470): 57-62. doi: 10.1016/j.virol.2014.07.052 [10] DAI J, WU S, KONG Y, et al. Nanosecond pulsed electric fields enhance the anti-tumour effects of the mtor inhibitor everolimus against Melanoma[J]. Sci Rep, 2017(7): 39597. doi: 10.1038/srep39597 [11] REN Zhi-gang, CHEN Xin-hua, CUI Guang-ying, et al. Nanosecond pulsed electric field Inhibits cancer growth followed by alteration in expressions of nf-kb and wnt/β-catenin signaling molecules[J]. Plos Onel8, 2013, 8(9): e74322. doi: 10.1371/journal.pone.0074322 [12] ALKASALIAS T, FLABERG E, KASHUBA V, et al. Inhibition of tumor cell proliferation and motility by fibroblasts is both contact and soluble factor dependent[J]. Proc Natl AcadSci USA, 2014, 111: 17188-17193. doi: 10.1073/pnas.1419554111 [13] ANG J, VASAIKAR S, SHI Z, et al. Web Gestalt 2017: A more comprehensive, powerful, flexible and interactive gene set enrichment analysis toolkit[J]. Nucleic Acidsres, 2017, 45(W1): W130-W137. doi: 10.1093/nar/gkx356 [14] RAO Xin, CHEN Xiao-dong, ZHOU Jun, et al. A digital controlled pulse generator for a possible tumor therapy combining irreversible electroporation with nanosecond pulse stimulation[J]. IEEE Trans Biomed Circuits Syst, 2020, 14(3): 595-605. doi: 10.1109/TBCAS.2020.2987376 [15] NAGATA S, TANAKA M. Programmed cell death and the immune system[J]. Nat Rev Immunol, 2017, 17: 333-340. doi: 10.1038/nri.2016.153 [16] MARI O G, NISO-SANTANO M, BAEHRECKE E H, et al. Selfconsumption: The interplay of autophagy and apoptosis[J]. Nat Rev Mol Cell Bio, 2014, 15: 81-94. doi: 10.1038/nrm3735 [17] HALL E H, SCHOENBACH K H, BEEBE S J. Nanosecond pulsed electric fields (nsPEF) Induce direct electric field effects and biological effects on human colon carcinoma cells[J]. Dna Cell Biology, 2005, 24(5): 24283-24291. [18] LÓPEZ-OTÍN C, BLASCO M A, PARTRIDGE L, et al. The hallmarks of aging[J]. Cell, 2013, 153(6): 1194-1217. doi: 10.1016/j.cell.2013.05.039 [19] CHO K H, JOO J I, SHIN D, et al. The reverse control of irreversible biological processes[J]. Wiley Interdisciplinary Reviews: Systems Biology and Medicine, 2016, 8: 366-377. doi: 10.1002/wsbm.1346 [20] STACEY M, FOX P, BUESCHER S, et al. Nanosecond pulsed electric field induced cytoskeleton, nuclear membrane and telomere damage adversely impact cell survival[J]. Bioelectrochemistry, 2011, 82: 131-134. doi: 10.1016/j.bioelechem.2011.06.002 [21] CHEN Miao, XIE Song-bo. Therapeutic targeting of cellular stress responses in cancer[J]. Thoracic Cancer, 2018, 9(12): 1575-1582. doi: 10.1111/1759-7714.12890 [22] ROTH C C, GLICKMAN R D, MARTENS S L, et al. Adult human dermal fibroblasts exposed to nanosecond electrical pulses exhibit genetic biomarkers of mechanical stress[J]. Biochem Biophys, 2017, 9: 302-309. [23] MOROTOMIYANO K, OYADOMARI S, AKIYAMA H, et al. Nanosecond pulsed electric fields act as a novel cellular stress that induces translational suppression accompanied by eIF2α phosphorylation and 4E-BP1 dephosphorylation[J]. Exp Cell Res, 2012, 318(14): 1733-1744. doi: 10.1016/j.yexcr.2012.04.016 [24] JANSEN E D, THOMAS R J, WILMINK G J, et al. Effects of nanosecond pulsed electrical fields (nsPEFs) on the cell cycle of CHO and Jurkat cells[J]. SPIE Proceedings, 2014, 8941: 89411R-1. [25] GUO J, WANG Y, WANG J, et al. Radiosensitization of oral tongue squamous cell carcinoma by nanosecond pulsed electric fields (nsPEFs)[J]. Bioelectrochemistry, 2017, 113: 35-41. doi: 10.1016/j.bioelechem.2016.09.002 [26] MAHLKE M A, THOMPSON G, ESTLACK L, et al. Effects of nano-second electrical pulses (nsPEFs) on cell cycle progression and susceptibility at various phases[J]. Proceedings of SPIE, 2014, 8585: 85850O. [27] MIAO X, YIN S, SHAO Z, et al. Nanosecond pulsed electric field inhibits proliferation and induces apoptosis in human osteosarcoma[J]. J Orthop Surg Res, 2015, 10: 104. doi: 10.1186/s13018-015-0247-z [28] MOROTOMI-YANO K, AKIYAMA H, YANO K I. Nanosecond pulsed electric fields activate AMP-activated protein kinase: Implications for calcium-mediated activation of cellular signaling[J]. Biochem Bioph Res Co, 2012, 428: 371-375. doi: 10.1016/j.bbrc.2012.10.061 [29] ZHANG X, ZHANG Y, CHEN J, et al. Nano second pulsed electric field inhibits malignant melanoma growth by inducing the change of systemic immunity[J]. Med Oral Patol Oral Cir Bucal, 2019, 24: 555. [30] BARDET S M, CARR L, SOUEID M, et al. Multiphoton imaging reveals that nanosecond pulsed electric fields collapse tumor and normal vascular perfusion in human glioblastoma xenografts[J]. Sci Rep, 2016, 7: 39597. [31] LASAITER B P, GUO S, BEEBE S J. Nano-Pulse stimulation ablates orthotopic rat hepatocellular carcinoma and induces innate and adaptive memory immune mechanisms that prevent recurrence[J]. Cancers, 2018, 10: 69. doi: 10.3390/cancers10030069 [32] MAMLOUK O, BALAGURUMOORTHY P, WANG K, et al. Bystander effect in tumor cells produced by iodine-125 labeled human lymphocytes[J]. Int J Radiat Biol, 2012, 88: 1019-1027. doi: 10.3109/09553002.2012.702297 [33] SOMMER G, KRALSCH S, STANGL V, et al. Secretory products from human adipocytes stimulate proinflammatory cytokine secretion from human endothelial cells[J]. J Cell Biochem, 2009, 106: 729-737. doi: 10.1002/jcb.22068 -

 ISSN
ISSN 



 下载:
下载: