-
生化检测分析在很多领域起重要作用,如何灵敏快速地针对某些低浓度物质进行定性或定量检测的需求日益增加。现有的高精度检测设备主要为固定的台式设备,其结构复杂、价格昂贵、需要专业人员操作等特性限制了其使用范围。随着微纳制造技术的迅猛发展,微流控检测平台为检测系统的小型化及可便携化发展带来了发展空间[1-3]。微流控检测平台相较于大型检测系统,具有样本消耗量小、成本低、芯片即抛即用、分析时间短等更具竞争性的优势[4]。然而,其在减小体积和样本量的同时,给检测的灵敏度带来了挑战。为了改善系统的检测灵敏度,微流控富集技术应运而生。该技术通过对样本预处理提高待检成分的浓度,从而提高检测灵敏度,很快成为微流控领域的研究热点之一。
当前,微流控富集技术发展呈现多样化态势,依据待富集物质是否主动参与到富集动态中,可将这些技术分为被动富集技术和主动富集技术。被动富集技术通常使用特殊通道结构设计、过滤辅助结构或具有特异性的捕获元来对目标物进行捕获富集[5-7],应用这类方法最大的优势是富集本身不需要外场的干预,但对样本的物理特性(如目标物的尺寸、刚度、黏弹度等)或免疫特性要足够了解,针对这些特性设计的通道结构往往较为复杂[8-9]。主动富集技术通常需要外场的干预来实现目标物的富集,典型技术有:基于梯度场建立的速度差异富集技术[10-12],主要包括等电位聚焦(isoelectric focusing, IEF)、电场梯度聚焦(electric field gradient focusing, EFGF)、温度梯度聚焦(temperature gradient focusing, TGF)等;基于缓冲介质特性差异实现的边界堆叠富集技术[13-15],主要包括扫描堆积(Sweeping)、等速电泳(isotachophoresis, ITP)和场放大样品堆叠(field amplified sample stacking, FASS)等;介电泳富集技术[16-17]和基于电渗流与电泳合力作用下的电动富集技术。其中,电动富集技术是一种实现相对简单的富集技术,而基于离子浓差极化(ion concentration polarization, ICP)效应的电动富集是目前效率较高的富集方式,其将微米通道由纳米结构串接,而纳米通道是具有离子选择性的,通过合理的电场条件控制,就能在纳米通道一侧的微米通道内形成特定离子的高效富集。ICP现象自首次被文献[18]发现以来,已广泛应用于微流控富集中[19-21]。利用ICP现象的电动富集方式无疑是目前最受欢迎的富集方式之一,但纳米工艺的制作还不具备普适性,这是限制其发展的主要因素。
现有的富集方式各自具有自身的适用领域与应用局限,包括需要掌握目标成分的物化特性、需严格的微纳通道工艺及电极工艺制备条件、需配置特性符合需求的缓冲介质等。而现有的大部分生化检测对象是具有负电荷属性的,如何利用微通道中的流体电动特性在简单的微通道结构中实现电动富集仍然具有较大的研究空间。前期研究表明,在T型微通道内,通过电渗流的诱导可以产生压力驱动流,实现持续稳定的流体进样,而优化的双T型通道结构在实现流体驱动的同时,还具有带电离子富集的潜能[22-23];同时液态金属可以注入微通道中作为微电极用于双T型微流控通道中,降低微通道中电极制作的难度[24]。本文在此基础上对双T型通道内荧光离子和皮质醇适配体的富集特性分别进行了实验研究,发现了皮质醇适配体的新型富集现象,并以此为基础实现了皮质醇的荧光检测。
-
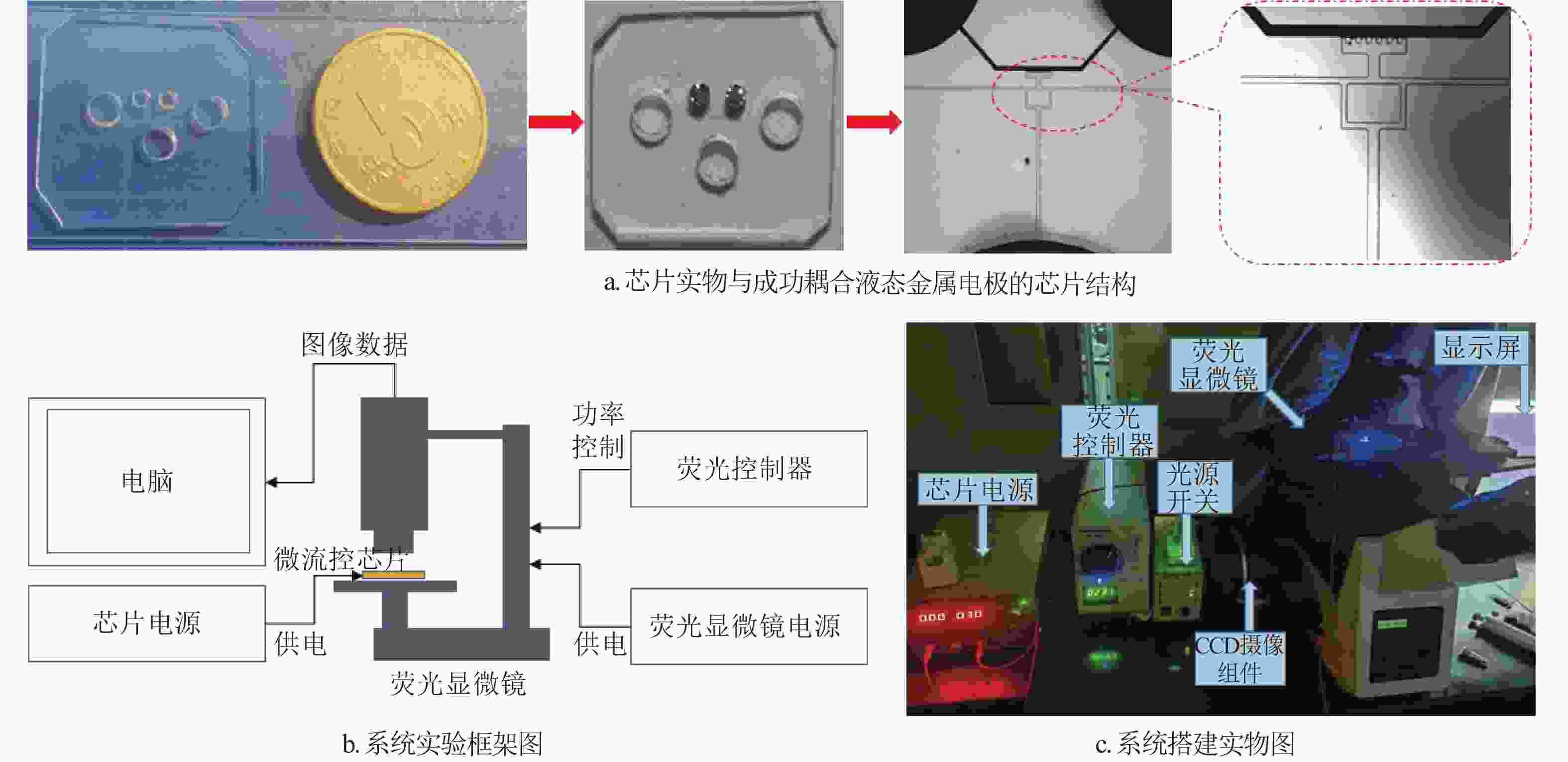
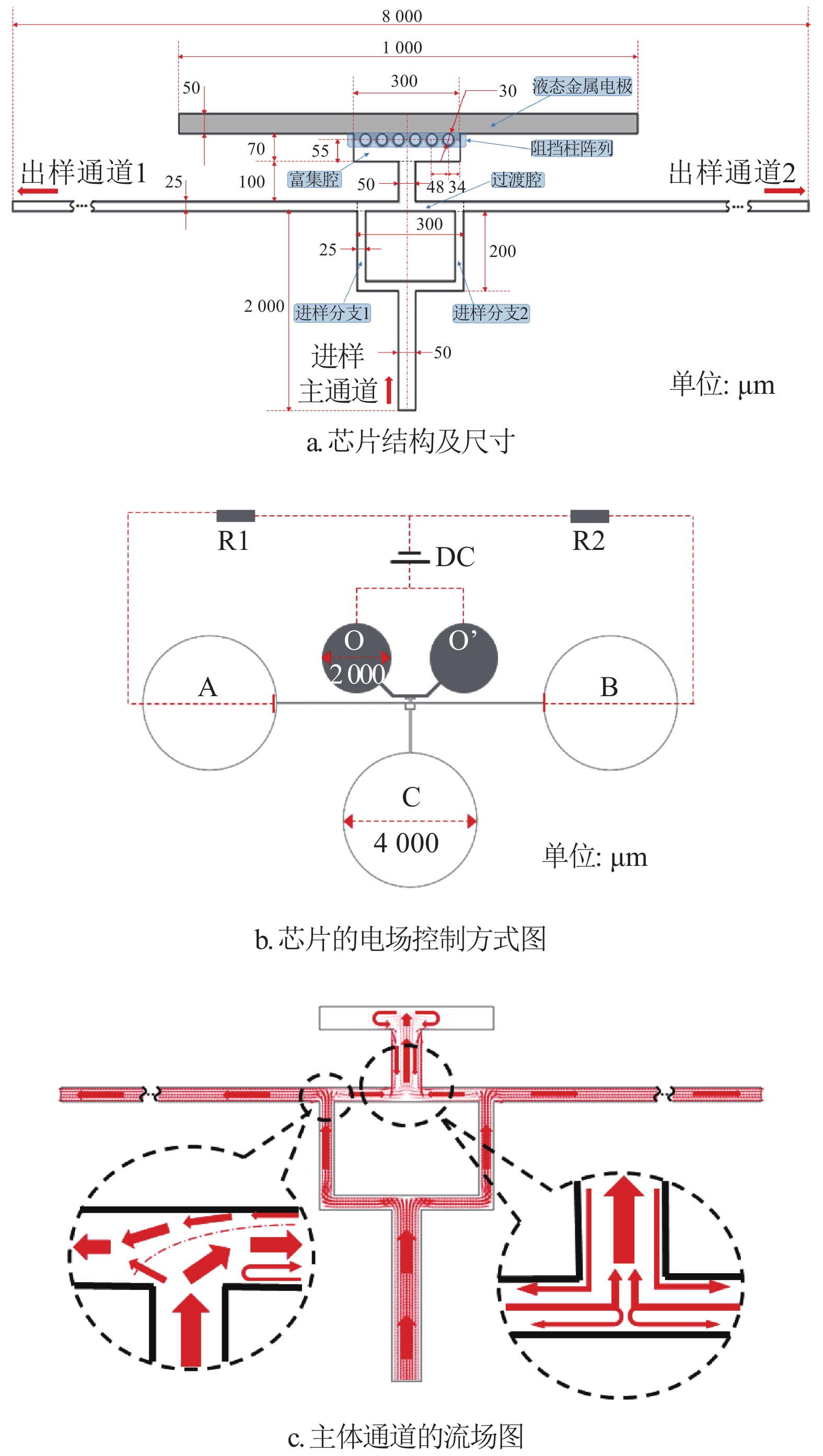
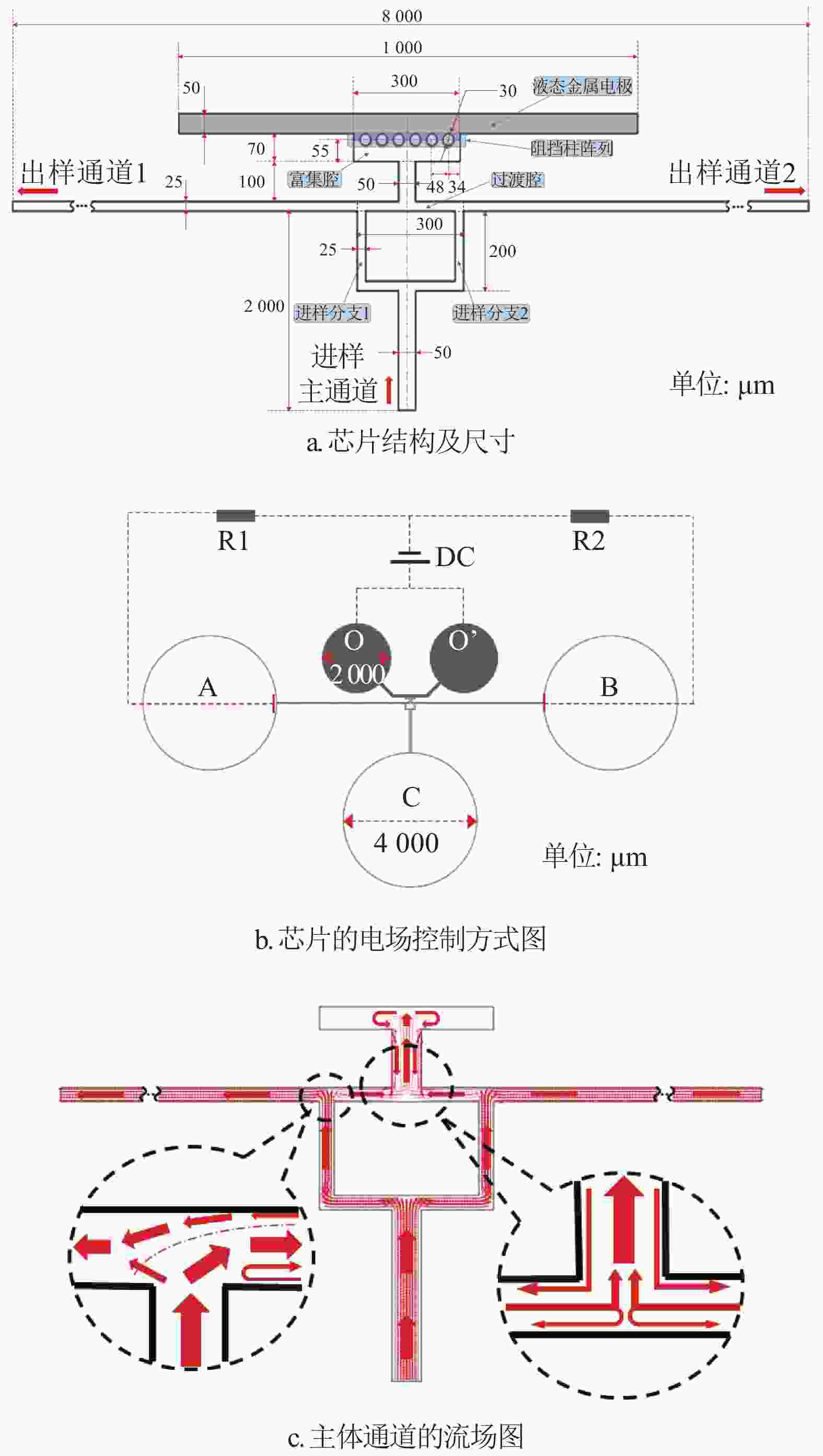
双T型电动富集结构及流体电动控制原理如图1所示,通道中心由液态金属提供形状规则的中心电极,并通过阻挡柱阵列与样本通道耦合接触。通道主体由进样通道(包括两个进样分支)、出样通道(分左右两侧)、过渡腔与富集腔4个部分构成,如图1a所示,芯片的实际制作模型如图1b所示,其中的5个圆形区域为芯片设计的打孔位置,O与O’所示孔位为液态金属注射控制孔位,直径均为2000 μm,A、B、C为样本溶液注入与存储孔位,直径均为4000 μm,芯片呈左右对称结构。
当通道如图1b所示接入直流电源DC后,流体在富集腔、过渡腔和两侧出样通道间产生沿着电场方向的电渗流,使得富集腔中心区域形成负压腔,此时流体可由进样通道吸入负压区域形成持续进样,其流场分布如图1c所示。该流场分布由微通道中的直流电场和层流场共同控制,其控制方程为:
$${\nabla ^2}{ V} = 0$$ (1) $${ E} = - \nabla { V}$$ (2) $${{u}} = - \frac{{{\varepsilon _r}{\varepsilon _0}\zeta }}{\mu }{ E}$$ (3) $$ \rho ({ u} \nabla ){ u} = \nabla [ - {{p}}{ I} + \mu (\nabla { u} + {(\nabla { u})^{\rm{T}}})]{\rm{ + }}{ F} $$ (4) $$\rho \nabla { u} = {{{0}}}$$ (5) 式中,V表示电势;E为由电势差形成的电场强度;ε0为真空中的介电系数;εr为流体的相对介电率;ζ为通道的zeta电势;μ为流体中的动态粘滞度;u为速度矢量;ρ为流体密度;p为压强;I为单位矢量;F为由粘滞度引起的流动阻力。其中,速度u为关键变量,由上述方程组求得,并根据其分布可得到流体的流场分布。同时,当样本溶液中目标成分为带电物质时,其在对流、扩散及电场迁移的共同作用下,会在流体通道中形成速度平衡点,由此形成富集效应。本实验主要研究负电荷物质在该结构中的电动富集性能。
-
实验以荧光素纳(fluorescein sodium salt, SIGMA, F6377, Germany)阴离子染料作为离子类物质代表,用荧光素纳和去离子水配制成浓度为7.8×10−8 mol/L的样本溶液1备用。该染料的激发光峰值波长为488 nm,经激发后的发射光峰值波长为518 nm。以皮质醇适配体15-1序列作为本次实验的DNA类分子物质代表,其序列号为:5’-GGA ATGGAT CCA CAT CCA TGG ATG GGC AAT GCG GGG TGG AGA ATG GTT GCC GCA CTT CGG CTT CAC TGC AGA CTT GAC GAA GCT T-3’[25]。为了观察皮质醇适配体的富集情况及后续皮质醇检测,将该序列5端修饰了羧基荧光基团 (6-FAM,6-Carboxyfluorescein)。该荧光基团的激发光峰值波长为494 nm,经激发后的发射光峰值波长为518 nm。将上述修饰过荧光基团的皮质醇适配体用去离子水配置成1 μmol/L的样本溶液2备用。
-
本结构的芯片制作简单,且其中心电极由液态金属电极构成,中心电极通道与样本运输通道耦合一体成型[24]。制作时,首先由光刻工艺得到通道阳模,再由PDMS浇注得到具有通道结构的芯片,并将其与玻璃键合、成功地注入液态金属后即可用,如图2a所示。实验系统平台主要包括微流控芯片、芯片控制电源、荧光显微镜、显微镜电源与荧光控制器及电脑显示组件,其系统框架与实物平台如图2b和2c所示。
-
将样本溶液、芯片和实验平台准备好后,按如下步骤开展实验。
1)在左右两侧样本溶液预留孔位A和B中分别注入4.5 μL去离子水,待液体在整个通道中流通;
2)调节显微镜载样平台至视场合适,打开荧光,在样本预留孔位C中注入6 μL样本溶液,接通芯片电源;
3)观察实验,等待数据记录。
-
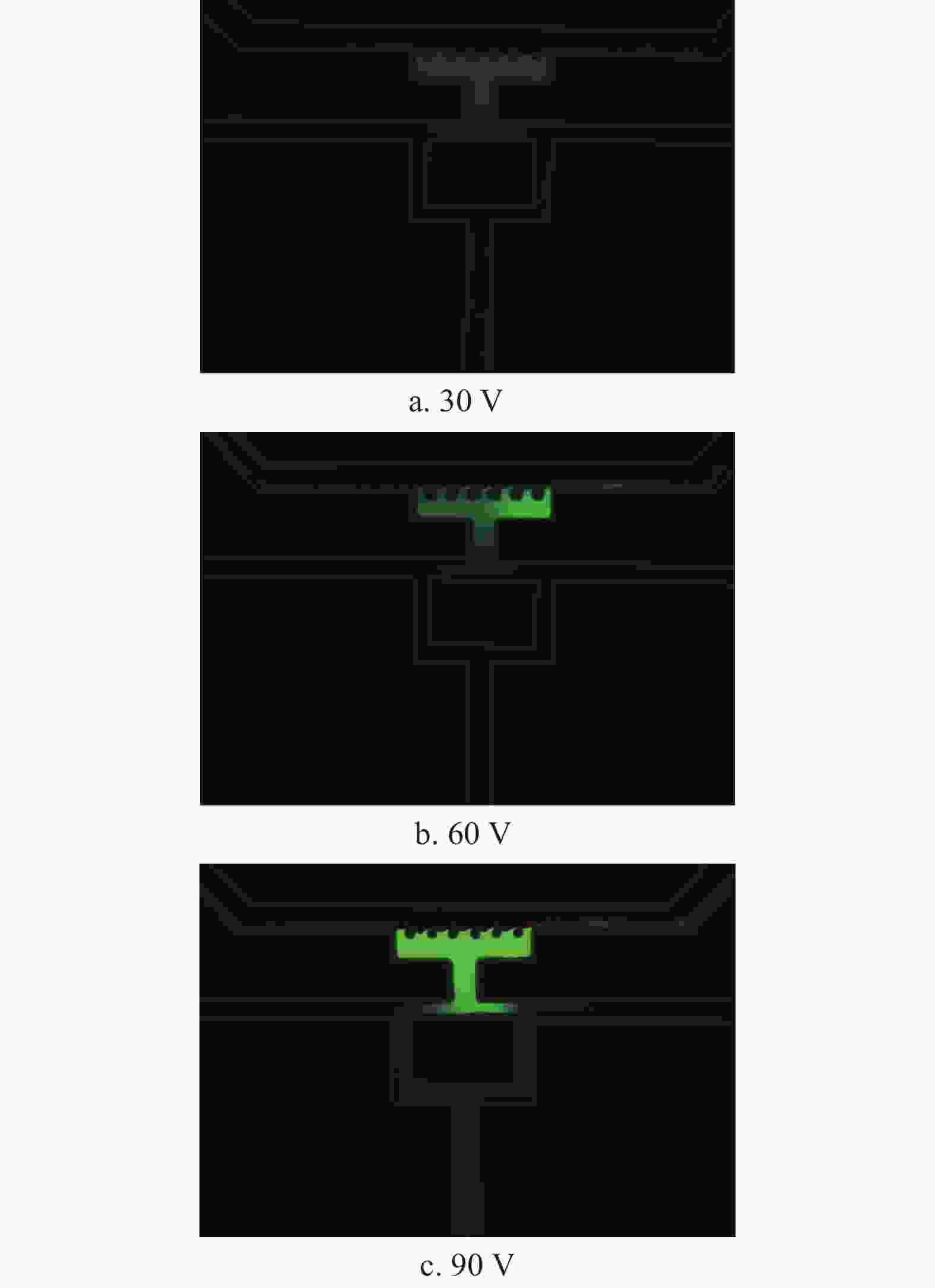
实验首先研究了样本溶液1在双T型通道内的电动富集状态,分别记录了当加载电压为30、60、90 V时的富集过程,记录时间为5 min,得到的结果如图3所示。由图可以看到,该通道结构对荧光阴离子具有明显的电动富集功能,富集区域主要集中在富集腔内。由荧光强度分布可以看到,在5 min内电压越高、富集腔内的富集效果越好。
前期研究表明,进样通道中两分支通道的间距对负电荷离子的富集效果有明显影响,间距越大,富集效果越好[23]。因此,实验研究中,将图1中芯片结构的分支通道间距进行了调整,制作了新的芯片结构,将图1中的芯片结构定义为结构1,新的芯片结构定义为结构2,并对两种结构在60 V电压下的富集过程进行了对比分析,如图4所示。其中,图4a显示了两种芯片结构及其在5 min内富集过程的对比,图4b为图4a中3个时间节点下(1、3、5 min)由荧光强度表征的富集倍率的量化结果(富集倍率定义为富集腔内平均荧光强度I与进样通道荧光强度I0的比值I/I0)。由图可以看到,结构2针对荧光离子的富集效果明显优于结构1,且两者富集区域均以富集腔为核心。
-
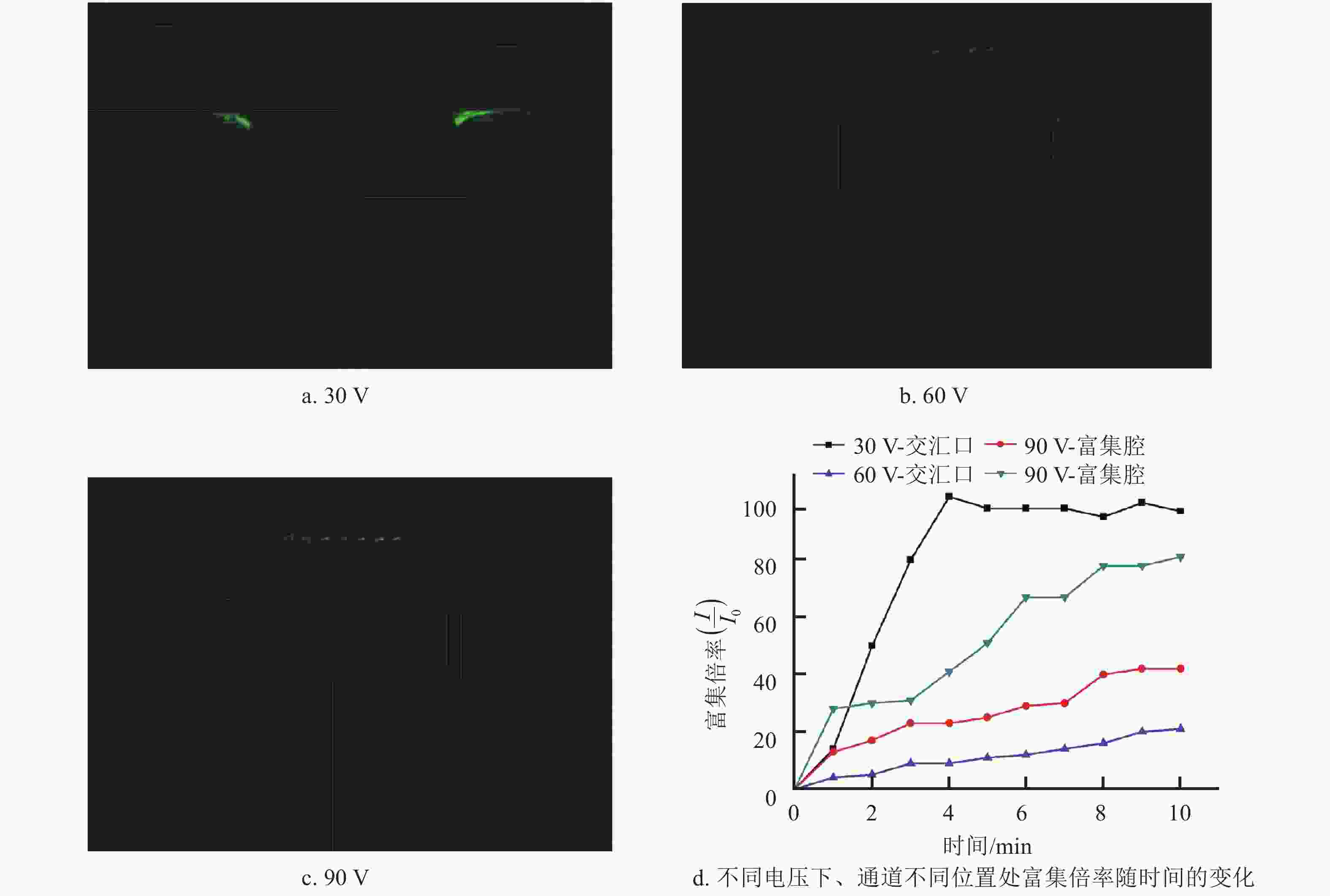
依据上述荧光离子的富集结果,本节针对富集效果更优的结构2展开了皮质醇适配体的电动富集研究。实验仍以加载电压为变量,分别记录了样本溶液2在电压为30、60、90 V时的富集过程,记录时间为10 min,得到的结果如图5所示。由图可以看到,该通道对皮质醇适配体的富集效果不同于对荧光离子的富集效果,电压较低(30 V)时,皮质醇适配体在入口通道与出口通道交汇口处出现了明显的富集(如图5a所示),随着电压增加,在通道交汇口的适配体逐渐向过渡腔和富集腔转移(如图5b所示),到90 V时,适配体在富集腔内与液态金属电极接触处汇聚(如图5c所示),此时,其富集区域与荧光离子在该通道结构中的富集区域一致。定义该结构中的局部荧光较强区域与进样主通道区域内的荧光强度之比为富集倍率(同样记为I/I0),得到不同电压下通道不同位置处的富集倍率在10 min内随时间的变化关系如图5d所示。
分析上述实验如下:进样流与出样流在进样通道与出样通道交汇口处首次发生流体交汇,此时进样流与出样流各自在通道内的宽度明显减小,而皮质醇适配体不同于荧光离子,其尺寸在微通道内不可忽略,当电压较低时,由电渗流诱导的流体流动速度较低,适配体由于通道骤然变窄会出现阻塞现象,由此逐渐在该区域形成了阻塞型富集;当电压逐渐增大,流体速度也相应增大,流体对适配体的拖拽力增强,更容易使适配体突破该交汇口进入过渡腔内,而当电压增大到一定值后,适配体基本可以突破过渡区域进入富集腔内形成与离子类物质相似的富集效果。由图5d可以看到,对于本结构而言,在30 V电压下通道交汇口形成的阻塞型富集效果明显优于90 V电压下富集腔内的富集效果,前者局部荧光强度可在4 min内迅速达到进样通道中荧光强度的100倍。
由此,本实验发现了该结构针对尺寸较大的DNA分子基于阻塞与驱动平衡的新型富集方式,即在双T型通道中,当通道尺寸与驱动电压相互匹配时,可以实现分子尺度的物质在通道进样流与出样流首次交汇口处的快速富集,该区域不与电极接触,可以避免样本物质与电极的相互腐蚀和渗透。
-
利用上述基于阻塞与驱动平衡的新型富集方式,本节对皮质醇进行了基于荧光猝灭−点亮机制的定性检测,检测原理如下:配制3种状态的样本溶液,第一种是被荧光基团6-FAM修饰的皮质醇适配体,标记为样本1;第二种为在第一种溶液的基础上添加了适量纳米片状结构的二硫化钼,标记为样本2;第三种为在第二种溶液的基础上添加了适量的皮质醇,标记为样本3。其中,样本1的浓度达到一定值后,通过特定波长的激光激发可以观察到与浓度对应强度的荧光;样本2由于二硫化钼的加入,其与荧光基团形成了Forster共振能量转移(FRET)对[26],使得荧光发生猝灭,因此观察不到荧光;样本3则由于皮质醇的加入,其与适配体通过碱基互补配对结合,其结合力远高于适配体与二硫化钼基面结合的范德华力,因此,适配体被皮质醇拉离二硫化钼,荧光被重新释放。根据3种样本溶液的荧光激发状态,即可判断皮质醇的存在与否,而双T型通道的富集效应可以加强局部荧光信号显示,更有利于低浓度皮质醇的检测。
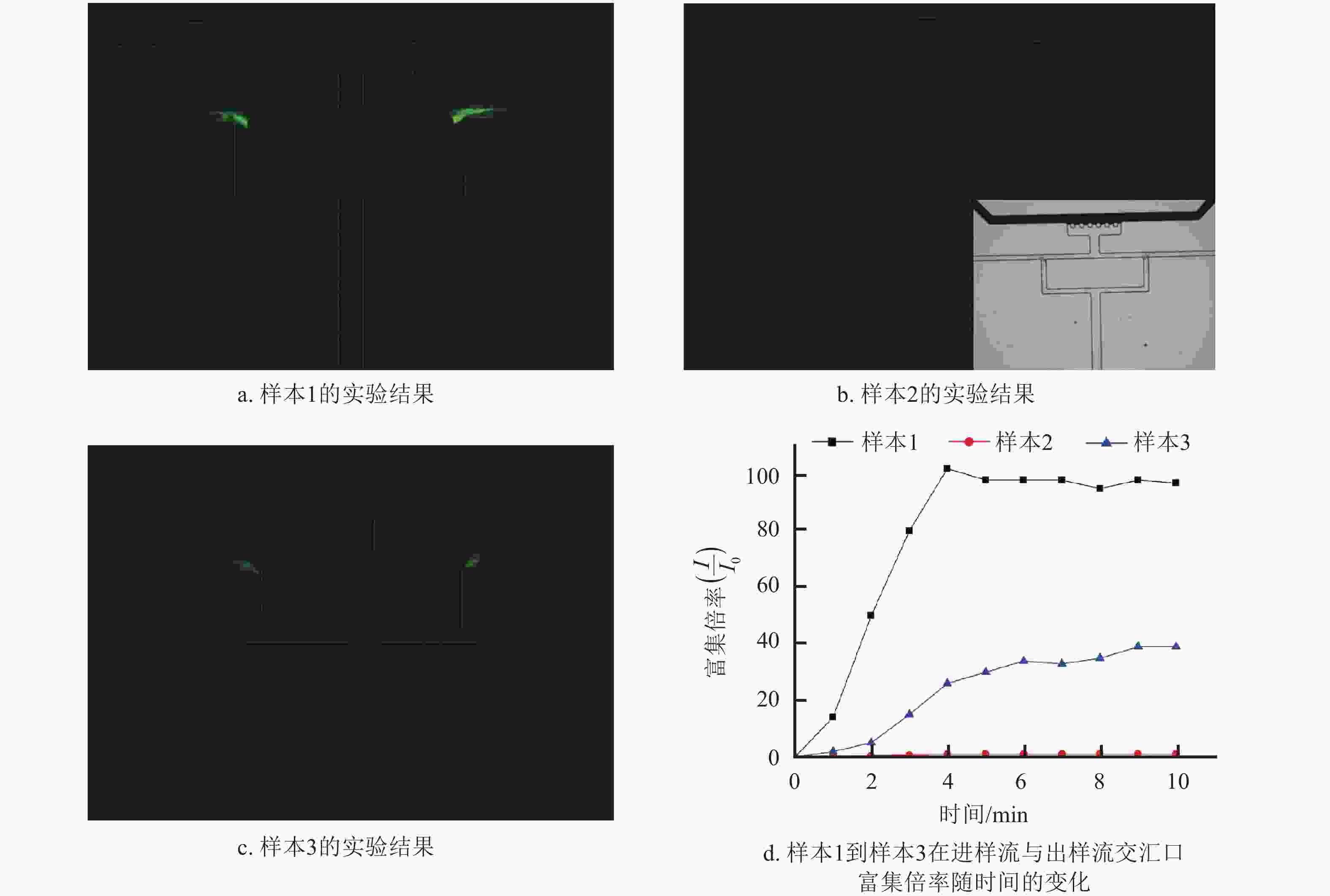
实验中,首先配置了100 μL浓度为1 μmol/L的适配体溶液,将其分成两等份,其中一份标记为样本1,在第二份溶液中加入超声剥离好的浓度为5 mg/mL的二硫化钼水溶液2.5 μL,震荡混匀10 s,又将其分为两等份,其中一份标记为样本2,另一份加入浓度为1 μg/mL的皮质醇溶液2.5 μL,震荡10 s,标记为样本3。将上述3份样本按前述实验步骤在30 V电压下依次展开实验,实验时间为10 min,得到的结果如图6所示。由图6a可以看到,样本1通过本结构实现了进样流与出样流交汇口处的阻塞型富集,在此处可以观察到明显的荧光信号;由图6b可以看到,样本2在通道中观察不到明显的荧光信号,但可以通过荧光显微镜自然光视场下看到结合二硫化钼的样本在进样流与出样流交汇口处发生汇聚,如图6b右下角所示;由图6c可以看到,样本3在进样流与出样流交汇口处也能观察到明显的荧光信号。这组实验证明了本通道对3组样本物质的富集均符合上述新型富集机制。图6d分别展示了样本1、样本2、样本3在通道交汇口富集区域内由荧光强度表征的富集倍率随时间的变化关系。由于样本富集使得局部荧光信号增强,本次实验通过双T型电动富集结构观察到了明显的荧光猝灭与点亮过程,证明了皮质醇的存在,皮质醇的检测浓度为0.1 μg/mL。后续工作中,通过各种参数的优化分析,包括结构尺寸的优化、3种溶质参与量的匹配优化、电压与结构的匹配优化等,该结构具有实现皮质醇更低浓度检测的潜能。
-
本文主要研究了双T型通道对不同物质的电动富集效应。首先,在微通道内流体电动控制理论研究的基础上,通过实验证实了双T型通道对荧光阴离子的电动富集功能;其次,对两种不同的结构分别进行了荧光离子富集,发现结构2具有更好的富集效果,由此展开了该结构对皮质醇适配体的电动富集性能研究,发现了一种低电压驱动下的新型富集现象,其富集区域远离电极,可以避免目标物质与电极接触造成的相互污染与渗透;最后,利用这种新型富集现象实现了对浓度为0.1 μg/ml皮质醇的荧光检测。实验表明,双T型通道对离子及分子尺度的负电荷物质均具有富集功能,但各自富集条件及有效的富集区域不同。该电动富集结构为在线微流控富集技术的发展及针对低浓度物质检测的微流控平台的发展提供了新的思路。
Electrokinetic Enrichment of Substances in Double-T-shape Channel
-
摘要: 微流控检测作为一种新型生化检测平台,具有快速、低成本的检测优势,得到了广泛关注,微流控富集技术对改善微流控检测系统的灵敏度具有重要意义。该文从能实现电动控制样本驱动功能的双T型通道出发,研究了该结构对荧光离子和皮质醇适配体的富集效果,发现了该结构针对不同尺度的物质具有不同的富集效应和富集区域。针对尺寸相对较大的分子类物质,可以在较低的电压下实现局部区域的快速富集,且富集区域远离电极,并利用该富集效应,完成了双T型通道对浓度为0.1 μg/mL的皮质醇的荧光检测。Abstract: Biochemical detection and analysis plays an important role in many fields, and many of the target substances are in low concentrations. Microfluidic detection platform has been developed for its low cost and rapid detection. Microfluidic enrichment is important to improve the sensitivity of microfluidic detection system. This paper studied the enrichment of fluorescent ions and cortisol aptamers using a double-T-shape channel, which could achieve the function of sample driving by electrokinetics. It is found that the structure has different enrichment effect and different enrichment area for different sizes of substances. For those substances with larger size relative to ions, it can be concentrated in a short time under low voltages, and the enrichment region is far away from the microelectrode, which is of benefit to both the sample and the electrode. By using this new enrichment effect, we achieved the detection of cortisol with the concentration of 0.1 μg/mL.
-
Key words:
- electrokinetics /
- electrophoresis /
- electroosmotic flow /
- enrichment rate /
- microfluidic enrichment
-
[1] MYERS F B, LEE L P. Innovations in optical microfluidic technologies for point-of-care diagnostics[J]. Lab on a Chip, 2008, 8(12): 2015-2031. doi: 10.1039/b812343h [2] KARLE M, VASHIST S K, ZENGERLE R, et al. Microfluidic solutions enabling continuous processing and monitoring of biological samples: A review[J]. Analytica Chimica Acta, 2016, 929: 1-22. doi: 10.1016/j.aca.2016.04.055 [3] ZHANG Dong-xue, BI Hong-yan, LIU Bao-hong, et al. Detection of pathogenic microorganisms by microfluidics based analytical methods[J]. Analytical Chemistry, 2018, 90(9): 5512-5520. doi: 10.1021/acs.analchem.8b00399 [4] ASIELLO P J, BAEUMNER A J. Miniaturized isothermal nucleic acid amplification, a review[J]. Lab on a Chip, 2011, 11(8): 1420-1430. doi: 10.1039/c0lc00666a [5] FAN Liang-liang, ZHU Xiao-liang, YAN Qing, et al. A passive microfluidic device for continuous microparticle enrichment[J]. Electrophoresis, 2019, 40(6): 1000-1009. doi: 10.1002/elps.201800454 [6] ZHAO De, HE Zhong-yuan, WANG Gang, et al. Three-dimensional ordered titanium dioxide-zirconium dioxide film-based microfluidic device for efficient on-chip phosphopeptide enrichment[J]. Journal of Colloid and Interface Science, 2016, 478: 227-235. doi: 10.1016/j.jcis.2016.05.054 [7] SUGIMOTO H, GHOSH D, CHEN S, et al. Immunocapture-LC/MS-based target engagement measurement in tumor plasma membrane[J]. Analytical Chemistry, 2018, 90(22): 13564-13571. doi: 10.1021/acs.analchem.8b03726 [8] HUR S C, HENDERSON M N K, MCCABE E R, et al. Deformability-based cell classification and enrichment using inertial microfluidics[J]. Lab on a Chip, 2011, 11(5): 912-920. doi: 10.1039/c0lc00595a [9] WANG Gong-hao, CRAWFORD K, TURBYFIELD C, et al. Microfluidic cellular enrichment and separation through differences in viscoelastic deformation[J]. Lab on a Chip, 2015, 15(2): 532-540. doi: 10.1039/C4LC01150C [10] HARDCASTLE C D, HARRIS J. Confocal raman microscopy for pH-Gradient preconcentration and quantitative analyte detection in optically trapped phospholipid vesicles[J]. Analytical Chemistry, 2015, 87(15): 7979-7986. doi: 10.1021/acs.analchem.5b01905 [11] YU Si-yang, YAN Chun-fang, HU Xian-qiao, et al. Isoelectric focusing on microfluidic paper-based chips[J]. Analytical and Bioanalycal Chemistry, 2019, 411(21): 5415-5422. doi: 10.1007/s00216-019-02008-5 [12] CAI Yu, NIU Ji-cheng, LIU Yu-qi, et al. Online sample clean-up and enrichment of proteins from salty media with dynamic double gradients on a paper fluidic channel[J]. Analytica Chimica Acta, 2020, 1100: 149-155. doi: 10.1016/j.aca.2019.11.048 [13] YANG Qing, CHEN Bei-bei, HE Man, et al. Sensitive determination of seven triazine herbicide in honey, tomato and environmental water samples by hollow fiber based liquid-liquid microextraction combined with sweeping micellar electrokinetic capillary chromatography[J]. Talanta, 2018, 186: 88-96. doi: 10.1016/j.talanta.2018.04.012 [14] MARCZAK S, SENAPATI S, SLOUKA Z, et al. Induced nanoparticle aggregation for short nucleic acid quantification by depletion isotachophoresis[J]. Biosensors and Bioelectronics, 2016, 86: 840-848. doi: 10.1016/j.bios.2016.07.093 [15] LIU Li-hong, WAN Qian, XU Xiao-yu, et al. Combination of micelle collapse and field-amplified sample stacking in capillary electrophoresis for determination of trimethoprim and sulfamethoxazole in animal-originated food stuffs[J]. Food Chemistry, 2017, 219: 7-12. doi: 10.1016/j.foodchem.2016.09.118 [16] ASBURY C L, VANDEN E G. Trapping of DNA in nonuniform oscillating electric fields[J]. Biophysical Journal, 1998, 74(2): 1024-1030. doi: 10.1016/S0006-3495(98)74027-5 [17] YANG Li-ju, BANADA P P, CHATNI M R, et al. A multifunctional micro-fluid ic system for dielectrophoretic concentration coupled with immuno-capture of low numbers of Listeria monocytogenes[J]. Lab on a Chip, 2006, 6(7): 896-905. doi: 10.1039/b607061m [18] PU Qiao-sheng, YUN Jong-sin, TEMKIN H, et al. Ion-enrichment and ion-depletion effect of nanochannel structures[J]. Nano Letters, 2004, 4(6): 1099-1103. doi: 10.1021/nl0494811 [19] GONG Ling-yan, OUYANG Wei, LI Zi-rui, et al. Force fields of charged particles in micro-nanofluidic preconcentration systems[J]. AIP Advances, 2017, 7(12): 125020. doi: 10.1063/1.5008365 [20] SHEN M, YANG H, SIVAGNANAM V, et al. Microfluidic protein preconcentrator using a microchannel-integrated nafion strip: Experiment and modeling[J]. Analytical Chemistry, 2010, 82(24): 9989-9997. doi: 10.1021/ac102149f [21] JIA Ming-jie, KIM T. Multiphysics simulation of ion concentration polarization induced by nanoporous membranes in dual channel devices[J]. Analytical Chemistry, 2014, 86(15): 7360-7367. doi: 10.1021/ac500536w [22] JIANG Hai, FAN Na, PENG Bei, et al. Characterization of an induced pressure pumping force for microfluidics[J]. Applied Physics Letters, 2017, 110: 184102. doi: 10.1063/1.4982969 [23] GONG Yan-li, JIANG Hai, BAI Yun-fei, et al. Numeirical studies of electrokinetically controlled concentration of diluted DNA molecules in a T-shaped microchannel[J]. IEEE Access 2020, 8: 5601-5610. [24] GONG Yan-li, PENG Bei, BAI Yun-fei, et al. Fabrication of a novel liquid metal microelectrode in microfluidic chip[J]. Modern Physics Letters B, 2021, 33: 2140005. [25] MARTIN J A, CHAVEZ J L, CHUSHAK Y, et al. Tunable stringency aptamer selection and gold nanoparticle assay for detection of cortisol[J]. Analytical and Bioanalytical Chemistry, 2014, 406(19): 4637-4647. doi: 10.1007/s00216-014-7883-8 [26] ZHU Chang-feng, ZENG Zhi-yuan, LI Hai, et al. Single-layer MoS2-based nanoprobes for homogeneous detection of biomolecules[J]. Journal of the American Chemistry Society, 2013, 135(16): 5998-6001. doi: 10.1021/ja4019572 -

 ISSN
ISSN 



 下载:
下载: