-
新型冠状病毒肺炎疫情发生后,如何有效应对、疫情何时出现拐点、何时能被有效控制等,已成为全中国乃至全球共同关注的重大问题。
HTML
-
本次疫情传播呈现出典型的复杂网络特征,可以用复杂网络疾病传播模型进行有效分析。复杂网络经典的疾病传播模型包括SI模型、SIR模型、SIS模型、SEIR模型等[1],在疾病传播分析中起到了重要作用。最基础的SI模型将人群划分易感状态(S)和感染状态(I)两类。易感人群以单位时间传染概率
$\beta $ 被感染人群感染,人群规模为易感人群与感染人群的总和,该模型没有考虑疾病被治愈或死亡的情况,在现实中较少能找到相应情景。SIR模型[2]在SI模型基础考虑了移出状态(R),对应疾病被治愈或死亡的状态,感染人群以单位时间传染概率$\gamma $ 由感染状态转移至移除状态。SIS模型[3]考虑了重复传染的情况,经历了完整感染周期后,感染人群以单位时间传染概率$\sigma $ 由感染状态转移至易感状态。SEIR模型在SIR模型基础考虑了潜伏状态(E),易感状态以单位时间传染概率$\beta $ 转移至潜伏状态,潜伏状态以位时间传染概率$\gamma $ 转移至感染状态。在疾病传播分析领域,复杂网络传播模型的应用较为广泛,众多学者对SARS[4-9]、中东呼吸综合征(MERS)[10-11]、HIV[12-14]等传染疾病展开建模分析。本文基于复杂网络理论,建立了带有潜伏期的COVID-19流行病SEIR传播动力学模型,对新型冠状病毒的传播及其拐点进行预测分析,试图为疫情防控提供理论支持和实践指导。
-
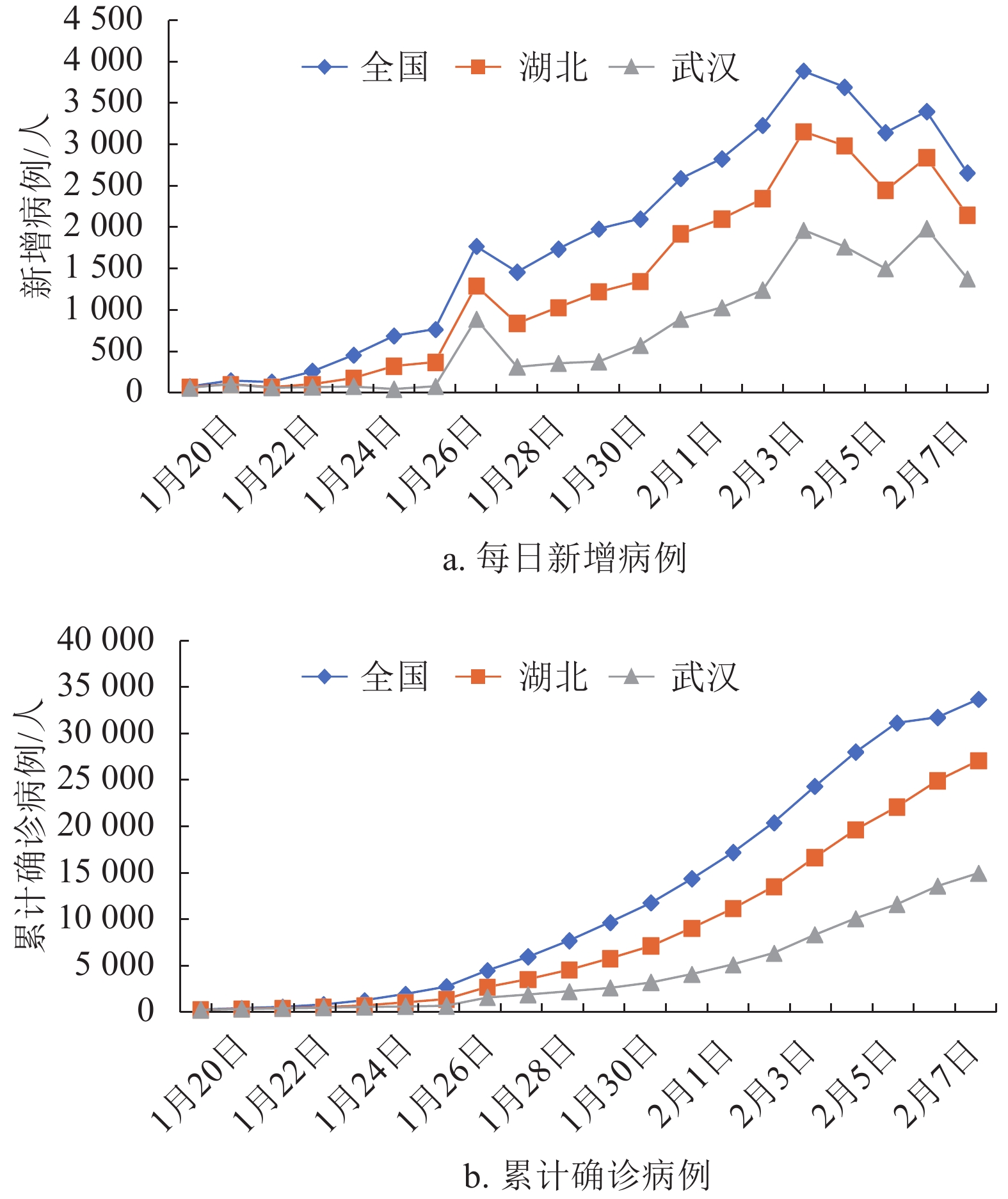
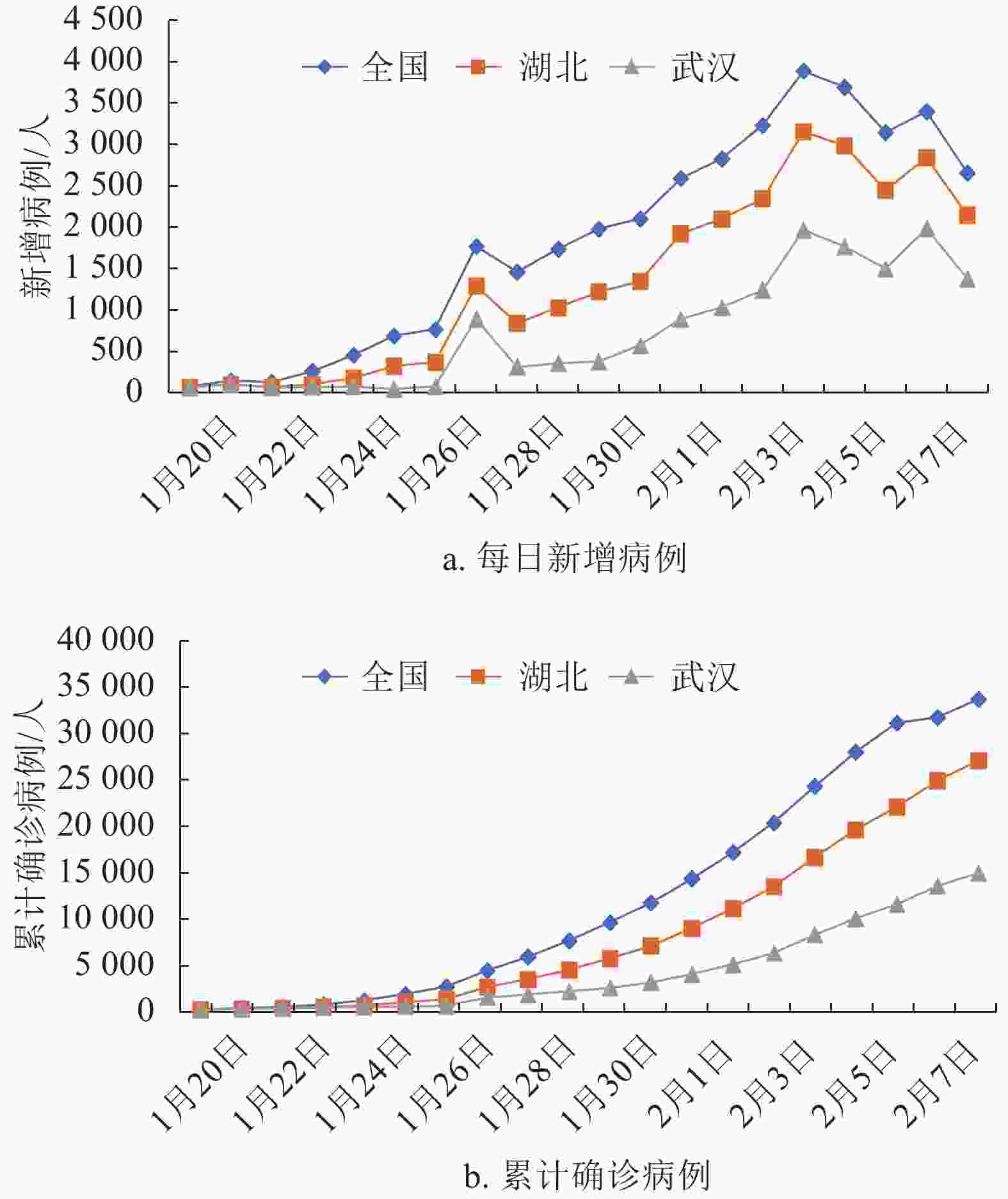
从全国、湖北和武汉市的疫情数据来看[15-17],新冠肺炎每日新增确诊病例虽略有波动,但总体呈现明显的上升趋势,且累计确诊病例上升趋势均较为明显(见图1)。从图1可观测到2020年1月27日每日新增确诊病例数有明显提高,经推测与病毒检测试剂盒的充足供给有关。2020年2月4日后全国新增病例数波动幅度明显减小,推测疫情已达到增速拐点附近。
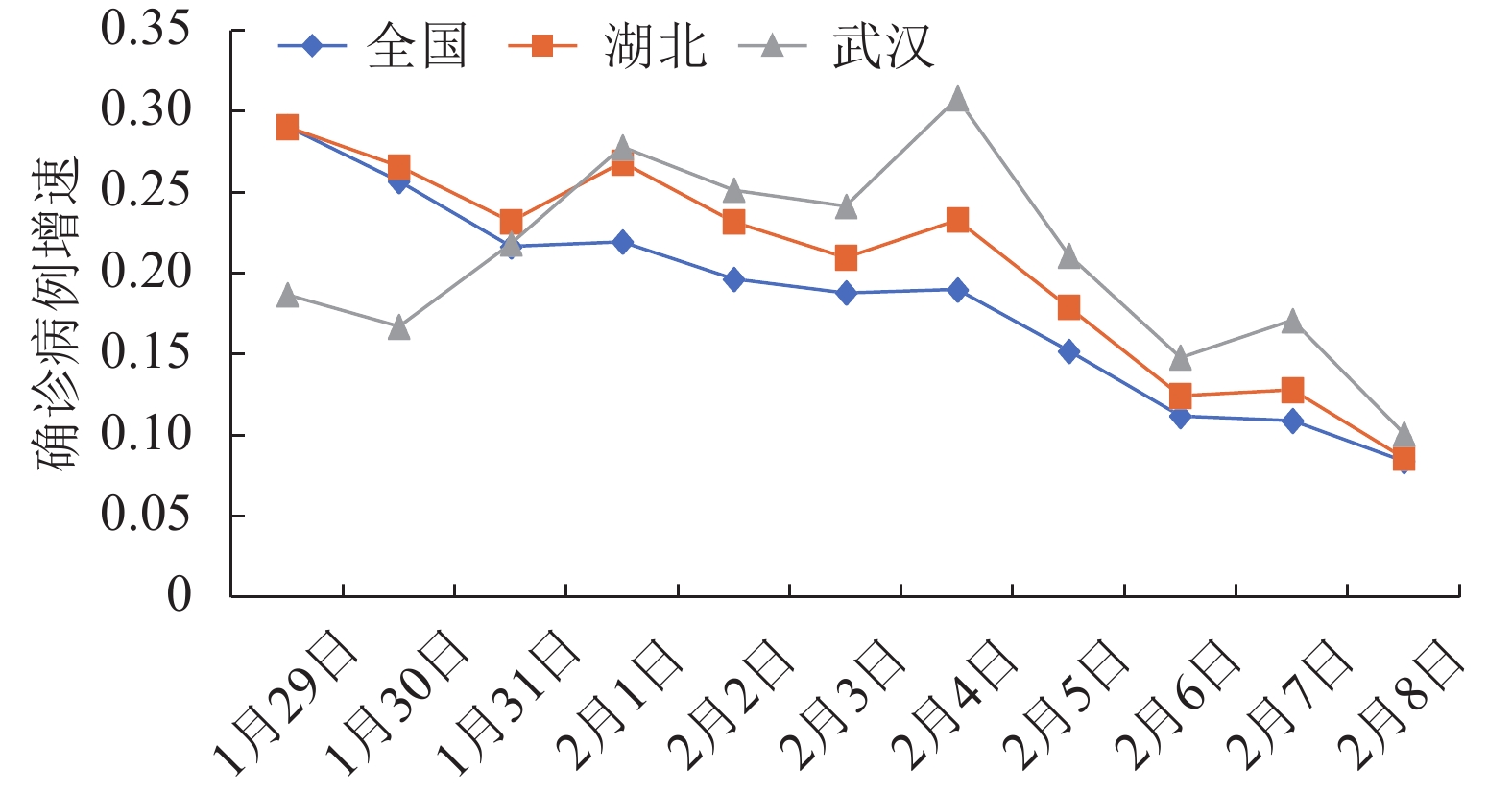
进一步地,从新增病例的增速来看(见图2),近几日来,武汉市新增确诊病例增速均超过湖北省和全国的增速,表明在各地政府相应政策措施下,全国总体疫情正在得到有效控制,但湖北特别是武汉,其疫情发展及防控形势依然比其他地区严峻。
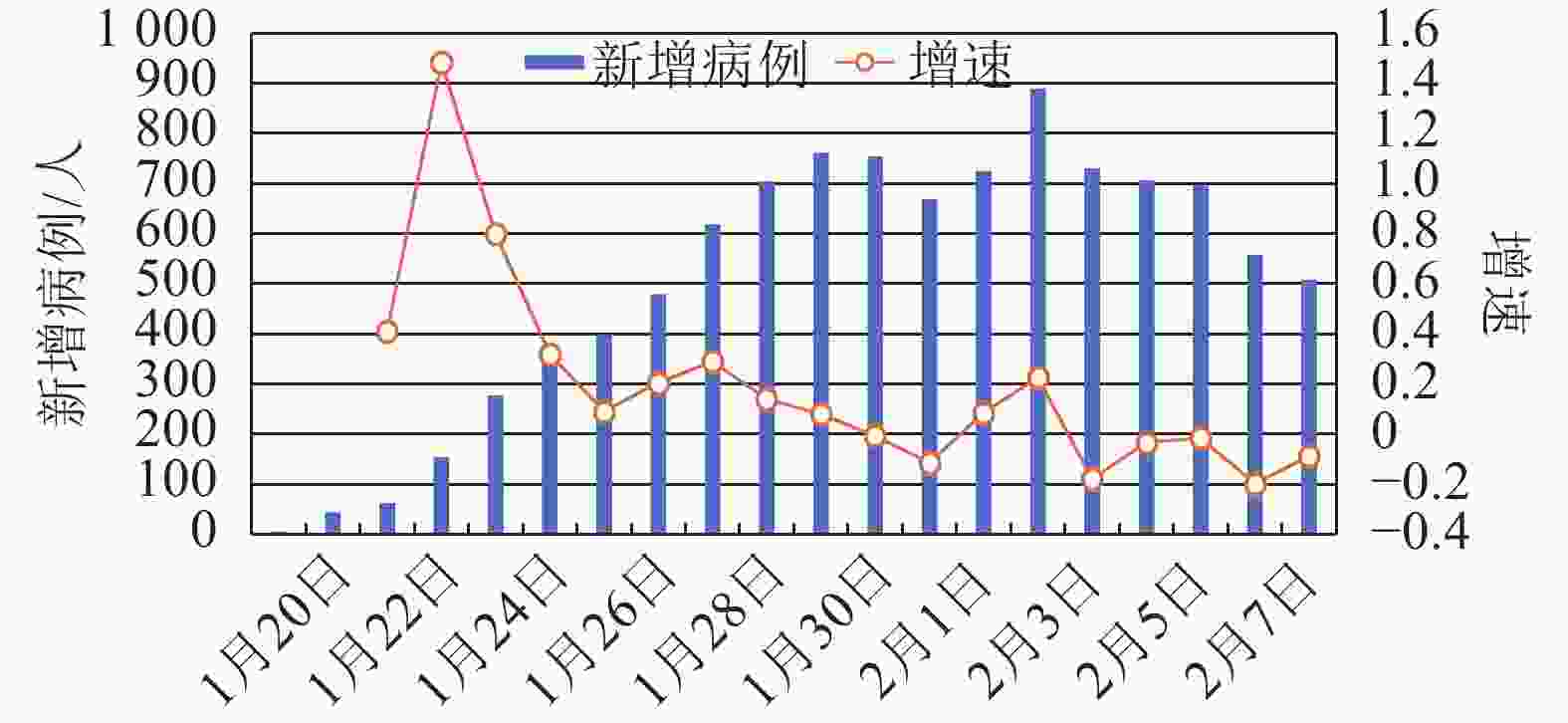
从除湖北省以外全国新增确诊病例的情况来看(见图3),尽管连续两日(2020年1月31日和2月1日)出现总体下降的趋势,但随着全国各地复工和返程乘客的增加,2月2日和2月3日,湖北省外全国新增确诊病例呈现不降反升的趋势,表明随着人口流动和各地人员的聚集,加大了疫情传播的风险,也增大了各地疫情防控的难度。
由此可见,截至2020年2月8日,全国疫情基本得到稳定控制,但是湖北特别是武汉,未来趋势依然严峻,疫情拐点依然不明朗。因此,针对武汉的特殊情况,结合本次新冠肺炎的传播特点,本文采用SEIR模型对新冠肺炎的传播进行研究。
-
从目前病例的观察来看,此次武汉疫情的特点主要是病毒具有潜伏期。截至目前,国家卫健委专家表示病毒的平均潜伏期大约在7天左右,最长14天,且在潜伏期也有传染性。而传统的SIR疾病传播模型,缺少对潜伏期的刻画,因此本文选择包含4种状态(易感状态-潜伏状态-感染状态-移出状态)的SEIR模型[4]来对此次武汉市疫情的动力学过程进行分析。
SEIR模型将研究对象分为S、E、I、R 4种类型:
1) S为易感状态(susceptible),表示潜在的可感染人群,个体在感染之前是处于易感状态的,即该个体有可能被邻居个体感染。对应本次疫情,S并不是指城市人口总数,因为并不是所有人都有接触到感染者的机会,在SEIR模型中只有患病群体直接接触到的人才处于易感状态。
2) E为潜伏状态(exposed),表示已经被感染但没有表现出感染症状来的群体。
3) I为感染状态(infected),表示表现出感染症状的人,该个体还会以一定的概率感染其能接触到的易感个体。
4) R为移出状态(removed),表示脱离系统不再受到传染病影响的人(痊愈、死亡或被有效隔离的人)。
记
$S({{t}})$ 、E(t)、I(t)、R(t)分别为时刻t的易感人群数、潜伏人群数、感染人群数、移出人群数,显然有$S({{t}}) + {{E}}({{t}}) + {{I}}({{t}}) + {{R}}({{t}}) \equiv {{N}}$ ,其中N为种群的个体数。假设一个易感状态在单位时间
$\tau $ 里与感染个体接触并被传染的概率为$\beta $ 。由于易感个体的比例为S/N,时刻t网络中总共有I(t)个感染个体,所以易感个体的数目按照如下变化率减小:相应地,潜伏个体的数目按照如下变化率增加,并且整体以单位时间概率
${\gamma _1}$ 转化为感染个体:感染个体数目由潜伏群体提供,个体同时以单位时间概率
${\gamma _2}$ 转化为移除状态:相应地移除个体以概率
${\gamma _2}$ 由感染群体往移除个体转化:
-
SEIR模型对于参数设置的敏感度较高,参数设置不合理将会使预测结果产生较大误差。根据上文构建的模型,从2019年12月8日我国第一个不明原因肺炎发现者的报道时间作为第一天。国家卫健委专家组成员于2020年1月21号接受采访表示新型冠状病毒肺炎的潜伏期在7天左右,本次新冠肺炎的潜伏期的均值假定为7天。根据文献[8]的研究表明,可设定
${\gamma _1}$ 为潜伏期的倒数${\gamma _1} = 1/7 \doteq $ $0.142\;9$ 。对于参数
$\beta $ 、${\gamma _2}$ 和$N$ 的设定,本文采用启发式算法[18],由于参数$\beta $ 表示的是易感个体单位时间里与感染个体接触并被传染的概率,参数${\gamma _2}$ 表示的是感染个体单位时间里转移为移出群体的概率,故$\beta ,{\gamma _2} \in [0,1]$ ,本文对该范围进行随机采样,粒度为$1 \times {10^{ - 4}}$ 。同时对N也进行随机采样,粒度为1 000,单位为人。把对$\beta $ 、${\gamma _2}$ 和$N$ 的采样过程进行迭代,设置迭代次数,不断对$\beta $ 、${\gamma _2}$ 和$N$ 进行随机采样并代入上一章节的微分方程求解,并通过均方根误差(RMSE)最小的约束原则与真实数据进行比对,优化得到该粒度下的最优解参数。本文将研究群体总数定义为
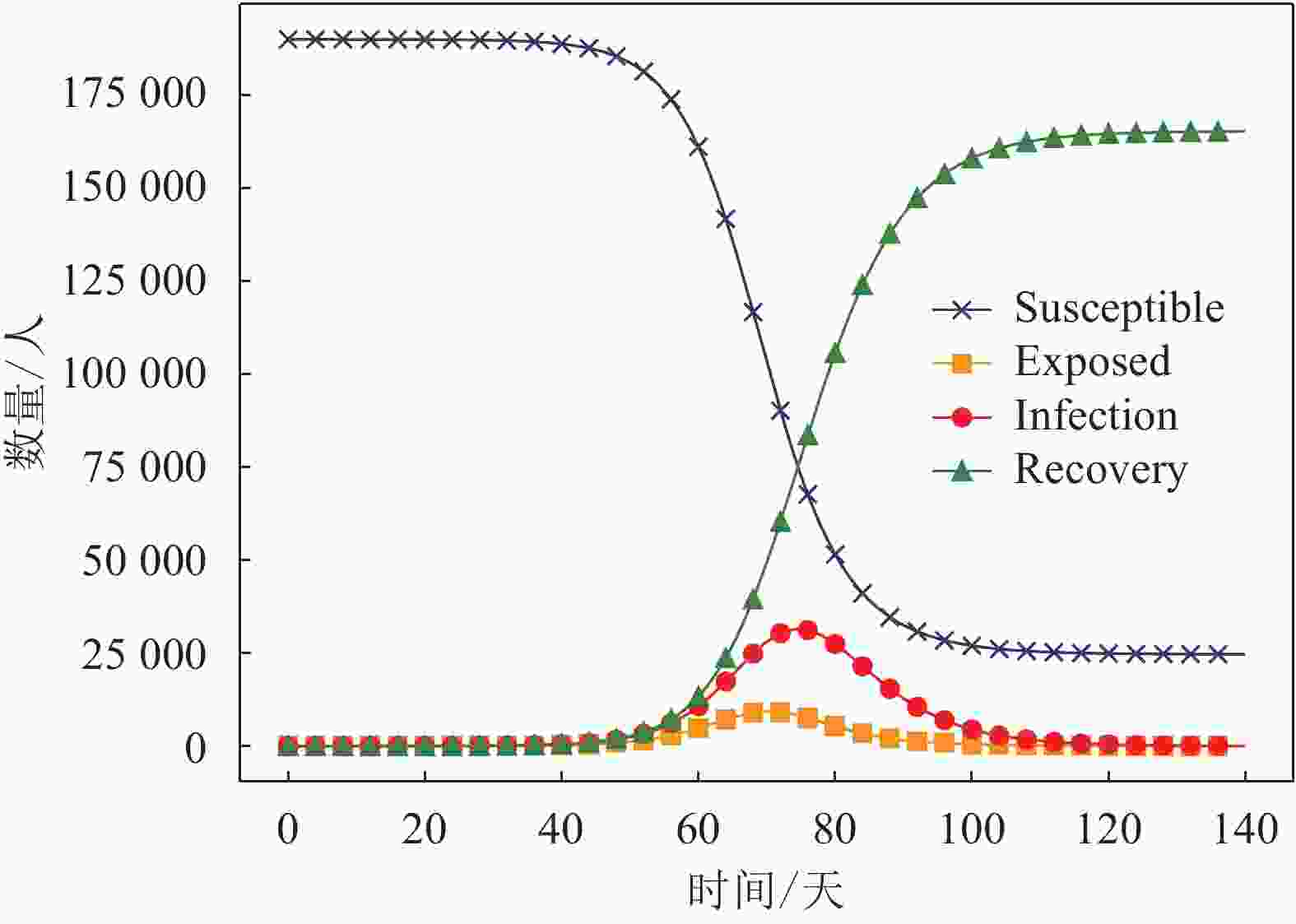
$N = S + E + I + R$ 。基于此,运用Python仿真平台进行模拟,可得新型冠状病毒传播过程中各群体随时间的演化结果,如图4所示。从图4可以看到,无论是E型(暴露者)还是I型(感染者),在初期都呈现上升趋势,但增长相对缓慢,在第40天−第50天(2020年1月16日−1月26日)左右开始加速增长,在第75天−第85天(2020年2月20日−3月1日)达到高峰,之后开始下降直至消失。
本文将武汉的确诊人数变化趋势与图中的I型人群进行拟合。当前(2020年2月8号)为新冠肺炎爆发的第63天,官方公布的确诊人数为14 982人[2]。
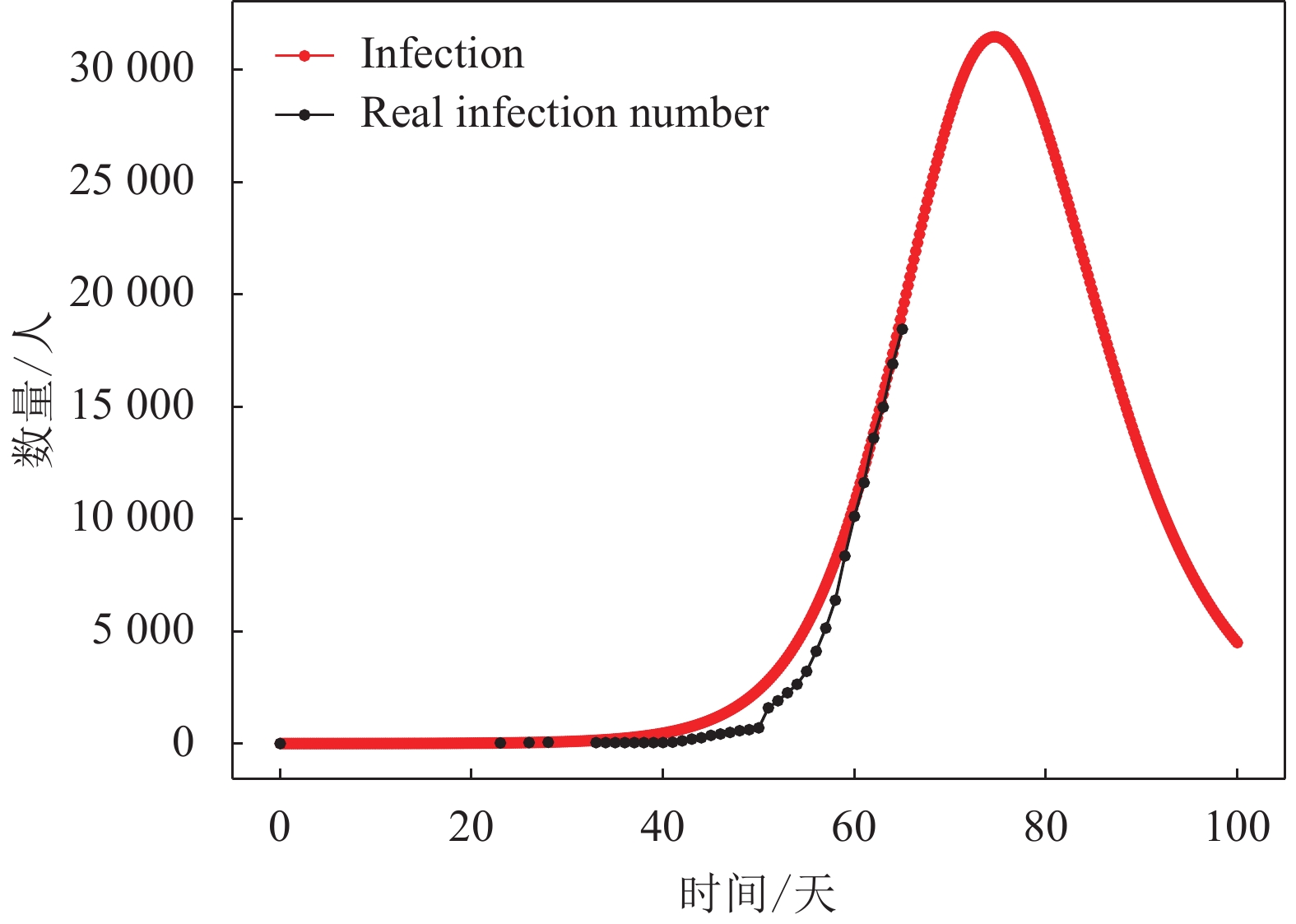
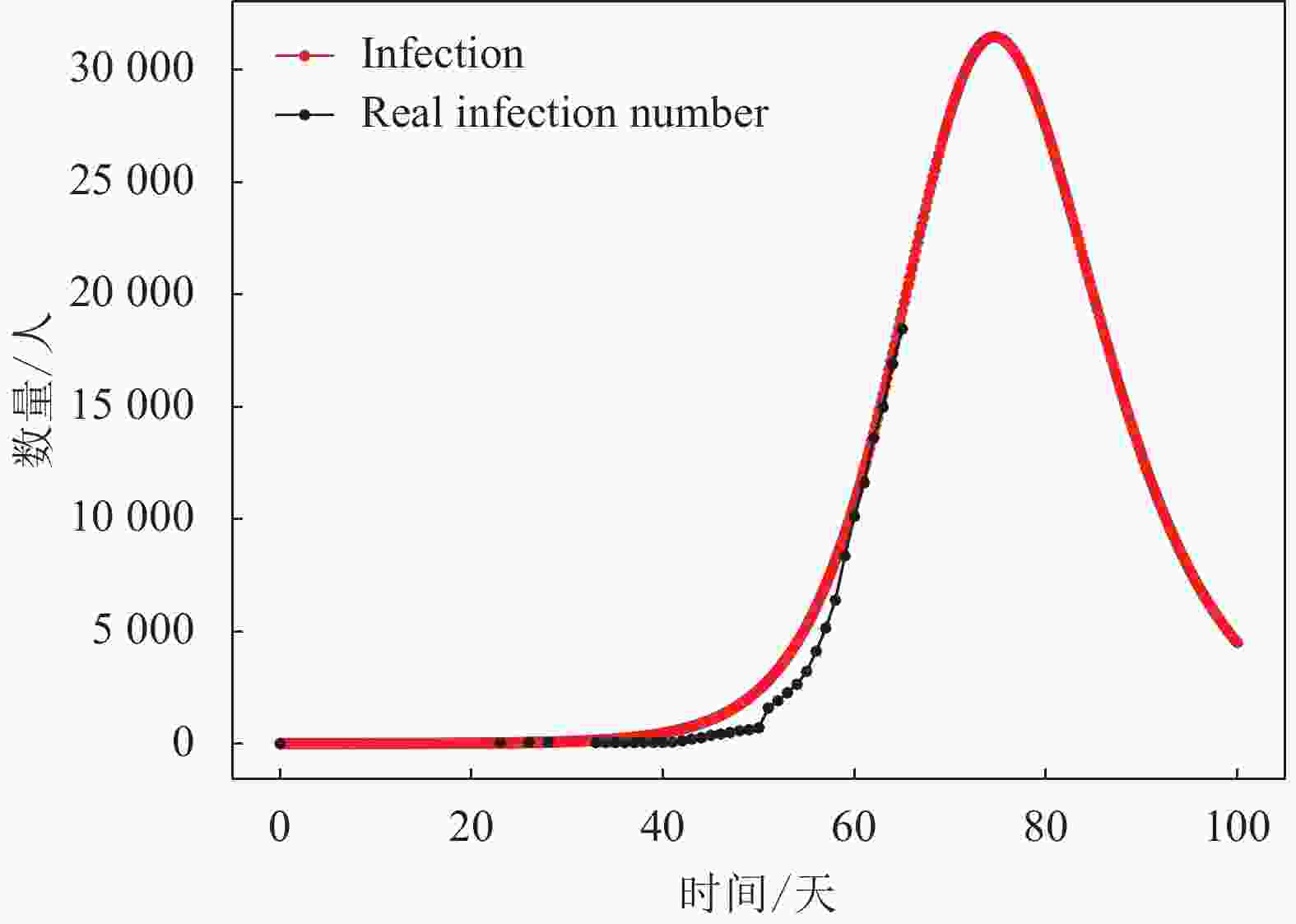
1) 若按照上述给定的潜伏期(即7天)进行仿真,可得到I型群体(即感染群体)人数的动力学演化结果如图5所示。从图5可知,当前武汉的感染群体演变阶段处于该曲线的上升部分,且研究对象的总人数N为189 000人左右,即武汉市接触新冠肺炎患者的总人数约为189 000人。根据I型曲线的发展趋势可预测该群体的近期发展趋势,I型群体人数将在一段时间的上升后达到高峰,武汉的新冠肺炎感染人数的峰值可达到约31 500人,可以看到此次疫情传播大约在第74天(即2020年2月19日)出现拐点,即疫情控制效果开始显现。
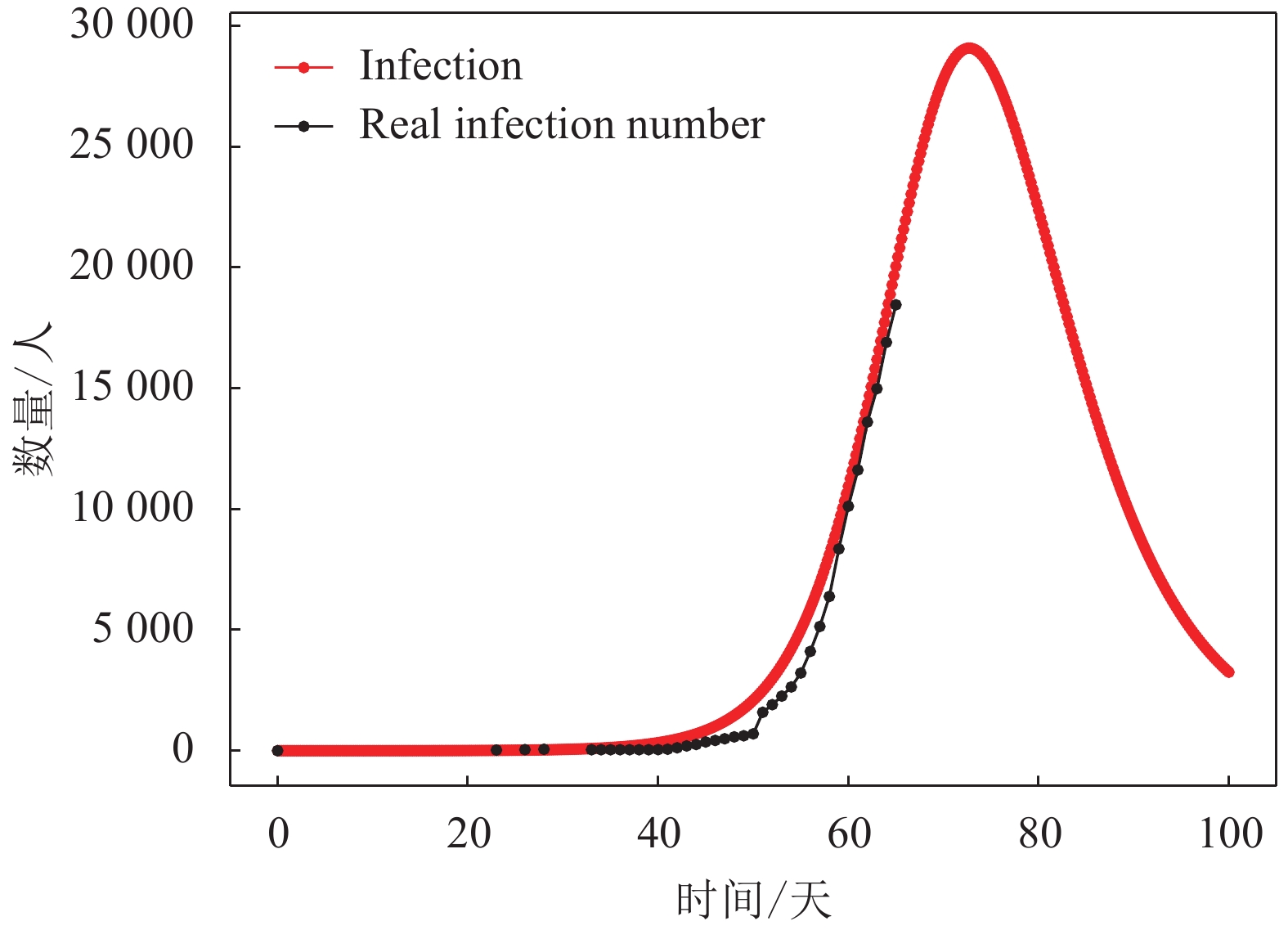
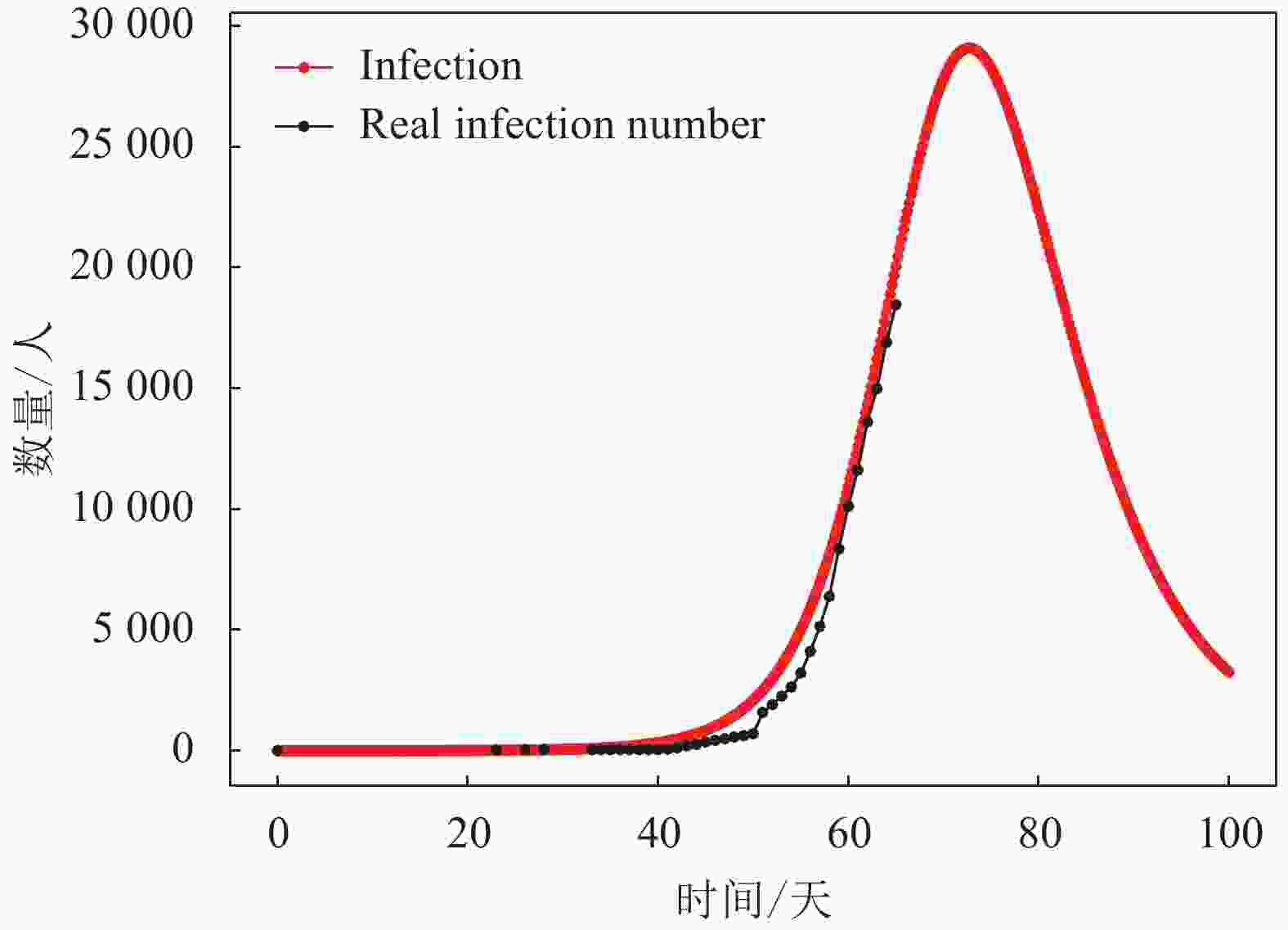
2) 由于对于疾病的统计研究尚处于初期阶段,关于疾病的统计学指标还没有公认结论,根据文献[19]的最新研究表明,平均潜伏期为5.2天。本文假定潜伏期为5天,经过仿真可得到I型群体(即感染群体)人数的动力学演化结果如图6所示。从图6可知,当前武汉的感染群体演变阶段处于该曲线的上升部分,且研究对象的总人数N为141 000人左右,即武汉市接触新冠肺炎患者的总人数约为141 000人。根据I型曲线的发展趋势可预测该群体的近期发展趋势,I型群体人数将在一段时间的上升后达到高峰,武汉的新冠肺炎感染人数的峰值可达到约29 000人,可以看到此次疫情传播大约在第71天(即2020年2月16日)出现拐点,即疫情控制效果开始显现。
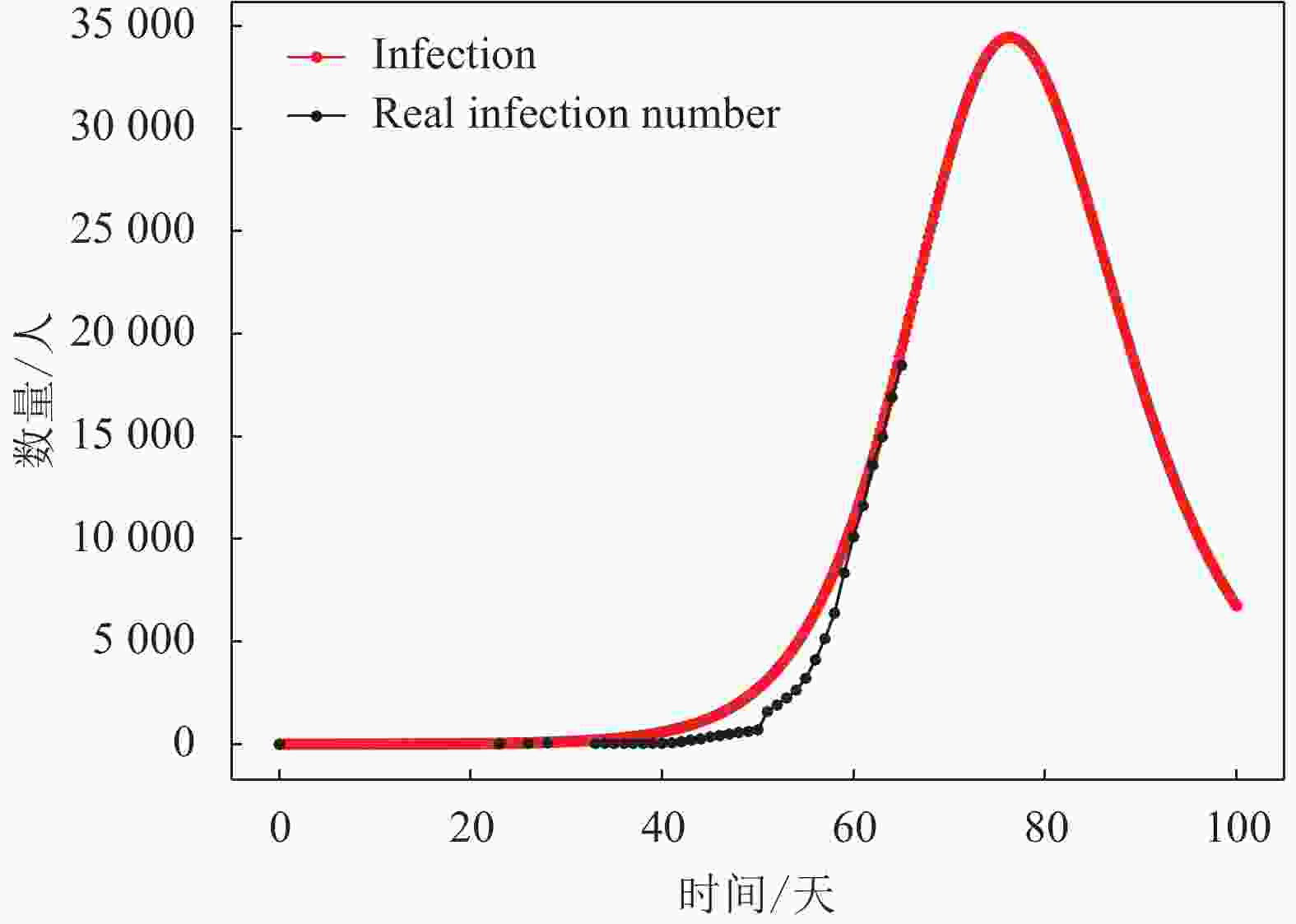
3) 若假定潜伏期为10天,可得到I型群体(即感染群体)人数的动力学演化结果如图7所示。从图7可知,当前武汉的感染群体演变阶段处于该曲线的上升部分,且研究对象的总人数N为215 000人左右,即武汉市接触新冠肺炎患者的总人数约为215 000人。根据I型曲线的发展趋势可预测该群体的近期发展趋势,I型群体人数将在一段时间的上升后达到高峰,武汉的新冠肺炎感染人数的峰值可达到约34 100人,可以看到此次疫情传播大约在第78天(即2020年2月23日)出现拐点,即疫情得到有效控制。
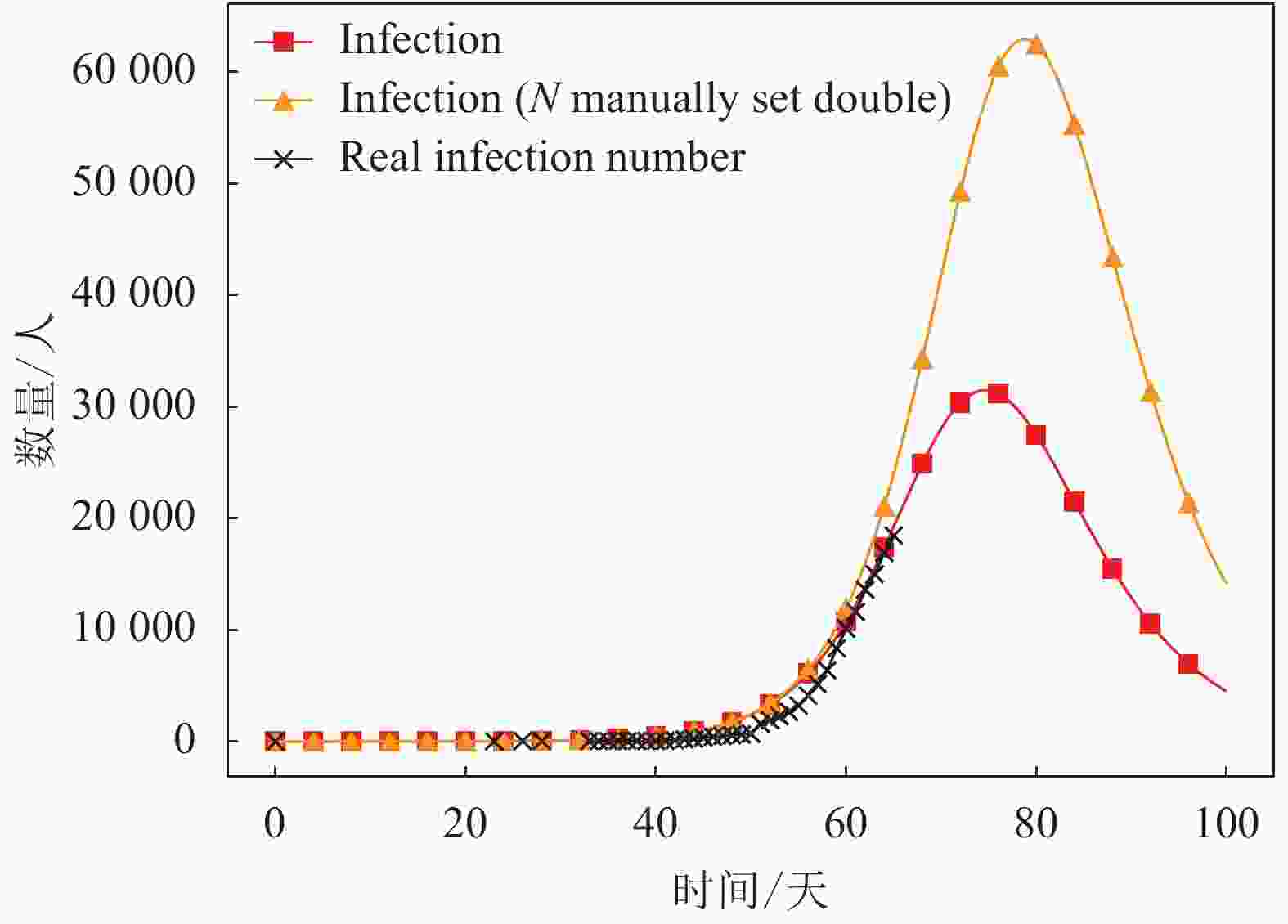
4) 基于潜伏期为7天的情景,为检验易感人群规模对预测结果的影响程度,本文将易感人群的初始值N人工设置为原参数的两倍,可得到同情景不同易感人口设置的情况下,I型群体(即感染群体)人数的动力学演化结果,如图8所示。可以看到,研究对象的总人数设定至原数值两倍时,新型肺炎感染人数的新峰值由31 500人升高至61 700人,约为原感染人数的两倍,响应较为敏感。而疫情传播人数的拐点由第74天延后至第78天,疫情得到有效控制的日期有少许延后,但响应度一般。
-
从上述分析可以得出以下结论:
1) 除湖北之外全国疫情基本得到有效控制。无论从全国、湖北还是武汉来看,确诊人数虽然依然呈现上升趋势,但除湖北外全国新增确诊人数开始出现拐点,表明全国疫情控制效果明显。但湖北特别是武汉,增速仍然比除湖北外其他地区高,其疫情发展和防控形势依然严峻。
2) 随着全国各地复工和返程乘客的增加,疫情传播的风险加大,各地疫情防控的难度也增大。从SEIR模型拟合的结果来看,武汉当前处于上升的中间阶段,并且在未来一段时间感染患者的数量依然保持上升。随着春节假期结束,越来越多的人返回武汉,在公众场合暴露的人员(易感人群)增加,人们将有更大概率接触到感染者,当疾病传播概率等条件不变的条件下,易感人群增加将会使疫情拐点向后延迟,并使感染总人口数增加。
3) 武汉疫情拐点出现时间在2020年2月20日至25日之间。在保持当前的治愈率水平的基础上,在3种潜伏期的条件下,I型群体的演变均呈现先上升后下降的变化趋势,且其变化过程存在拐点。当平均潜伏期分别为5天、7天与10天的条件下,武汉市的感染患者数量达到的峰值分别为29 000人、31 500人与34 100人,且疫情传播的拐点分别为第71天(2020年2月16日)、第74天(2020年2月19日)与第78天(2020年2月23日)。武汉感染患者的数量依然持续保持上升。武汉当前处于上升的中间阶段,并且在未来一段时间感染患者的数量依然保持上升。
4) 易感人群数量增加将会提升感染人群的峰值,并且使疫情传播人数的拐点后移,可能使得疫情的增速出现多个峰值。春运返程将会向城市输送数量庞大的人口,人员聚集在高铁站、地铁站、飞机场等公共场所。当人群中存在潜伏病例或感染病例时,将会大幅度提高易感人群的数量。
在此基础上,本文给出以下防控措施:
1) 建议武汉市大中小学开学时间延迟到3月后,确保学校安全。此次疫情的万幸之地是高校基本上没有被感染。2) 随着全国各个地方复工和返程乘客的增加,一定要做好返乡人员的排查、隔离工作,防止疫情反弹。3) 需要尽快对存在确诊或疑似病例患者的楼栋和小区进行全面消毒,斩断这些楼栋和小区的后续传染能力。对主要街道进行统一消毒。4) 组织传染病专家在电视和微信上开辟专题或公众号,介绍流行病防治的经验、故事和防护知识,进行公共卫生知识、良好卫生习惯的宣传普及。5) 组织高校心理学教师和社会组织心理服务团队,通过电视、微信、网络等方式,介绍隔离期间心理疏导的有效方法,舒缓焦虑和恐慌心理。6) 利用中小学生隔离在家的机会,教育部门统筹布置各个学校加强对学生进行公共卫生知识、公共卫生习惯的普及教育,而不是着急网络课程学习。

 ISSN
ISSN 



































 DownLoad:
DownLoad: