-
具体词和抽象词在大脑的表征差异引起了认知科学和神经科学领域的广泛关注。具体词指称可以通过感官感觉到的所指物,表征感觉运动信息,具有高想象性;抽象词指称无法直接感知的想法或精神状态,表征基于语言的信息,具有低想象性[1]。语言病理研究表明,两种词类的加工有着不同的神经机制。对部分失语症患者和诵读困难患者以及顶叶下部受损的阿尔茨海默患者而言,抽象词的加工难度大于具体词[2-3]。相反地,伴有颞叶下部损伤的语义痴呆患者表现出对具体词加工的难度大于抽象词,因为颞叶下部是视觉联合皮层的重要区域,该区域的受损可能会影响到具体词的加工[2, 4]。
具体性效应促使研究者探究两种词类加工的神经机制的差异。具体性效应指具体词比抽象词的加工难度更低,加工效果也更好,具体性效应也反映抽象词和具体词加工的差异。不同的理论被提出以解释该效应。双编码理论[1]认为,具体词在两个独立但又相互关联的系统——主要位于左半球的语言加工系统和主要位于右半球的意象加工系统——同时进行加工;而抽象词则主要在位于左半球的语言加工系统中加工。语境有效性理论否认两种词类加工效应的不同是由不同的神经机制造成的,而认为是对语境信息的利用程度不同造成的[5]。还有理论认为,具体词和抽象词的表征框架不同,抽象词通过相互关联的方式组织起来,而具体词通过相似性的类别组织起来[6]。具身认知理论认为,语义的表征是通过对该词语在感觉运动、社会情感以及内在感受等方面的仿真实现的,抽象词和具体词的差异在于表征权重的差异[7]。
大量功能性磁共振成像(Functional Magnetic Resonance imaging, fMRI)方面的研究深入探究了其背后的神经机制,比较集中地表明与具体词相比,抽象词更多激活了负责词汇语义表征和控制的额叶和颞叶区域;而与抽象词相比,具体词激活了负责感知和心理意象加工左侧的枕叶和顶叶[8–11]。元分析认为相比具体词,抽象词更多激活了额下回和颞中回,相反,具体词更多激活后扣带、楔前叶、梭状回以及海马旁回[12]。然而相关研究得到的结果并不完全一致,有研究指出具体词和抽象词都激活了位于左侧的多模态联合脑区,包括与语言加工相关的左侧颞叶。具体词更多激活了双侧的角回以及背外侧前额叶皮层,而抽象词更多激活了与语音加工和语言工作记忆相关的左侧额下回区域[13]以及左侧前额叶皮层,特别是与顶叶相连的额极部分,该部分调节抽象词的关联性加工[14]。但失语症患者加工抽象词和具体词的功能性磁共振成像扫描结果显示,抽象词激活了语言区域,而具体词额外激活了多模态联合区域[15]。还有部分研究没有发现具体词在任何脑区有更大的激活[16]。
观察两种词类加工的脑活动的差异在一定程度上揭示了两者加工的脑机制的不同,但对具体性效应脑机制的探究并不足以描述单个词类加工的神经机制。一项PET研究显示,与静息态相比,具体词加工任务激活了位于双侧外侧裂的颞上回,包括颞极和赫氏回,双侧的颞下回后部以及梭状回后部[17]。另一项fMRI实验显示,与静息态相比,具体词加工显著激活了双侧顶上小叶、双侧梭状回、左侧额下回、前扣带、左侧颞中回以及右后侧颞上回等。而与静息态相比,抽象词加工激活双侧梭状回、双侧额下回、左侧顶下小叶、右侧顶上小叶、右侧颞上回以及左侧颞中回等[16]。类似实验中使用的材料主要集中于印欧语系,特别是英语,极少使用汉语材料。英语是表音文字,书写位是音位;汉语是表意文字,书写位是词素。汉字与意义有更直接的关联。目前以汉语词汇为实验材料的ERP研究发现,相比于抽象词,具体词加工在刺激呈现200~300 ms的时间窗内在左半球诱发出更大的负波N170,该波幅是视知觉加工早期的ERP成分[18],这个时间差较之前以英文为材料的实验更短,说明中文表达的语义信息被更早地激活[19-20]。在300~500 ms时间窗内,中文具体名词比抽象名词在额叶和中央顶叶部位诱发了更大的N400成分[19],该成分表明在语义信息上与先前语境整合[21],说明汉语具体词加工有更大的语境方面的支持。
目前对具体词和抽象词的加工,以汉语词汇为实验材料的研究很少,实验任务也主要是词汇判断,并且主要的实验手段为ERP。本研究采用自由回忆范式,探究汉语具体词和抽象词记忆的神经机制。记忆加工有别于词汇判断任务,词汇判断任务是孤立任务,而在记忆加工任务中,单个的词会被相互关联起来,因此背后的神经机制也有所不同。fMRI可以有效反映特定任务在全脑范围的激活情况,并进一步通过软件分析形成相应的激活图像来定位与认知任务相关的脑区,具有较高的时空分辨率,能够更精确地观察到大脑的激活状况[22]。
本研究使用fMRI探究中文具体词和抽象词的情景记忆加工过程中的脑激活情况。词汇的情景记忆加工涉及与词汇相关的语义和情景记忆的提取和关联,是较词汇判断更深层次的加工。本文的研究问题是中文具体词和抽象词的情景记忆加工在脑激活的神经机制方面是否有差异和共同点。
-
28位以汉语为母语的大学生参与了磁共振实验(14位女性,平均年龄19.14岁,年龄段18~24岁)。所有被试都是右利手,有正常或者矫正正常的视力。无人报告精神疾病和幽闭恐惧症,该研究得到了电子科技大学伦理委员会的许可,所有被试都签署了同意书。
-
记忆编码任务由36个具体词和36个抽象词组成,词性均为名词。所有的词汇都是中文二字词,两种词类的词频相似,都是100~500频次/百万词。15名不参加正式实验的志愿者使用李克特七级量表对词条的具体性进行评分,2分以下的为具体词(平均分1.2352,标准差0.2578),4分以上是抽象词(平均分4.9255,标准差0.5302)。
独立样本t检验结果显示实验采用的两种词类的具体性有显著差异(t=45.171, p<0.001)。刺激呈现采用E-Prime 2.0,屏幕大小41×23 cm2,像素分辨率1366×768,屏幕更新频率为60 Hz。
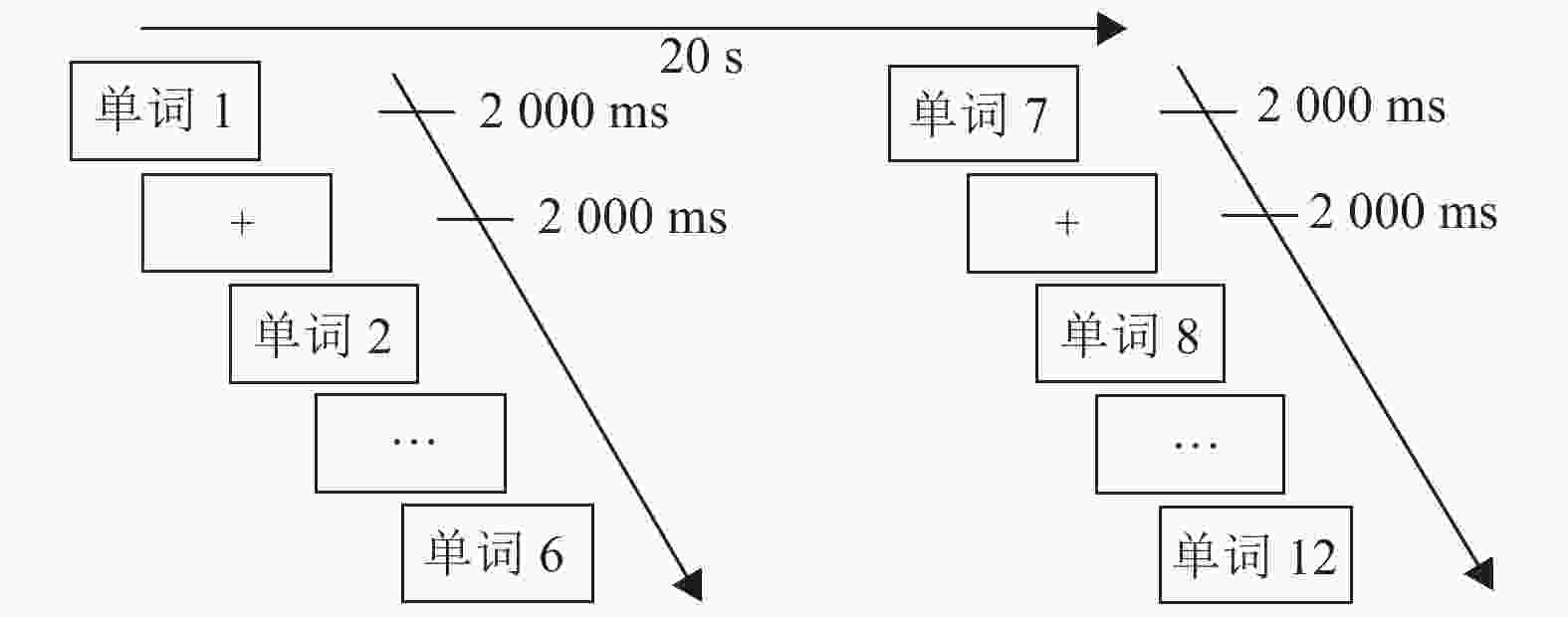
实验任务分为两部分:记忆编码和自由提取。实验范式是基于文献[23]的研究。记忆编码部分(如图1所示)进行fMRI扫描,使用block设计。一个block包含36个具体词,一个包含36个抽象词,两种词类的呈现顺序平衡。每一个block中,36个具体词/抽象词被分为6个mini-block,每个包含6个单词。首先呈现单词,呈现时间为2 s;接着呈现注视点,持续时间也是2 s,被试被要求记住这些呈现过的单词。两个mini-block之间的间隔为20 s,其间被试被要求处于睁眼静息的状态。整个记忆编码的过程在功能性磁共振进行扫描,被试在距离眼睛55 cm的投影屏幕上看呈现的单词。该过程完成10 min以后,进入到记忆自由提取阶段。自由提取阶段持续15 min,被试被要求在一张白纸上写下在记忆编码阶段出现的词,不要求词汇出现的顺序。
-
实验中,每个被试进行两个run的扫描,一个是具体词记忆编码,一个是抽象词记忆编码,顺序是平衡的。每个block包含36个具体词或36个抽象词。整个过程持续484 s。
-
在电子科技大学高场磁共振脑成像重点实验室使用3.0 T GE Sigma扫描仪进行功能磁共振成像扫描。功能MRI图像采用梯度法获取,扫描参数如下:每个 block有190个EPI卷;TR=2000 ms;TE=30;FA=90°;FOV=240×240 mm2;矩阵大小=64×64;体素大小=3.75×3.75×3 mm3;43层。利用磁化预处理的梯度回波序列得到高分辨率全脑结构T1加权图像(176层;TR=1900 ms;TE=2.26 ms;厚度为1 mm;矢状视野为256×256 mm2;翻转角度为90°;矩阵为256×256;体素大小为1×1×1 mm3)。
-
使用DPARSFA 4.1版本(www.restfmri.net forum/DPARSFA)对数据进行预处理。丢弃每个被试的前5个函数时间序列以达到信号平衡。
用中间层进行时间层校正。头动校正通过仿射配准进行调整。使用MNI(Montreal Neurological Institute)模板对结构像和功能像进行空间配准。空间平滑使用8 mm高斯核函数。使用时间高通滤波器(默认截止值为128 s)去除低频信号漂移。所有被试头部均无超过1.5 mm的平移或1.5°旋转,符合本研究头动参数的剔除标准。
在单个被试水平上,采用一般线性模型(General Linear Model, GLM),将具体词和抽象词的再认正确率设为回归量进行统计分析,空间运动的6个附加估计参数作为协变量。每个试次的起始序列通过卷积标准血流动力学响应函数形成设计矩阵的回归式。为了测试具体性效应,设置了两组对比:具体词>基线和抽象词>基线。在组水平上,采用独立样本t检验的随机效应模型进行统计分析。所有的激活在体素水平上采用Family-Wise Error Rate(FWE)方法对激活进行校正(p<0.05),簇团大小为30个体素[24]。
-
本文研究了抽象词和具体词记忆的行为表现及其神经基础。被试完成两种词的记忆编码和自由回忆,在编码阶段进行磁共振扫描。实验结果分为两部分:行为和大脑针对不同任务激活的结果。自由回忆的正确率使用SPSS 20进行配对样本t检验。
-
自由回忆阶段,被试被要求在纸上写下所记住的在记忆编码阶段呈现的单词,可以忽略顺序问题。结果表明,具体词的自由回忆的正确率显著高于抽象词自由回忆的正确率(t=5.216, p<0.001),符合具体性效应,说明具体词比抽象词更容易加工和记忆。
-
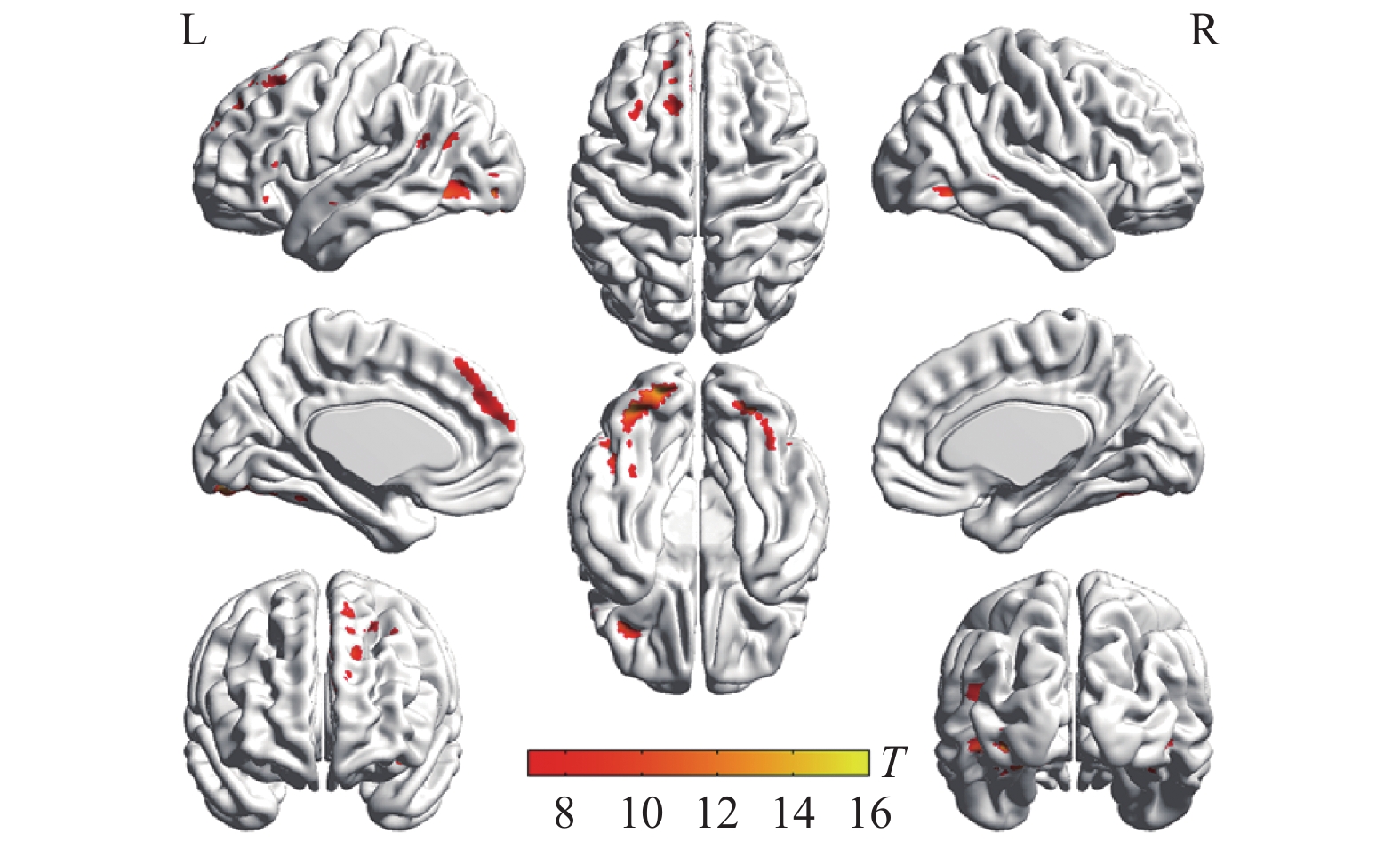
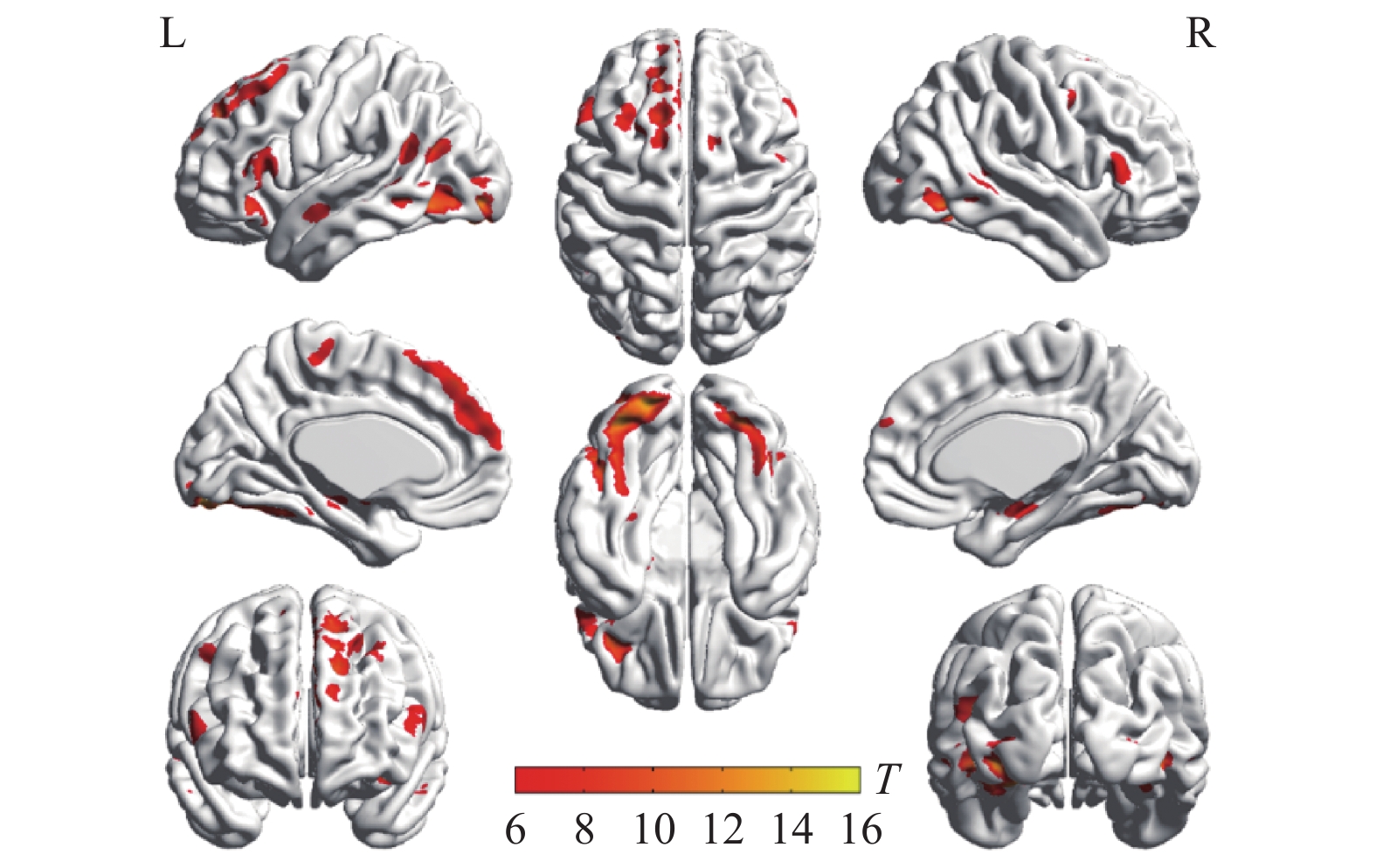
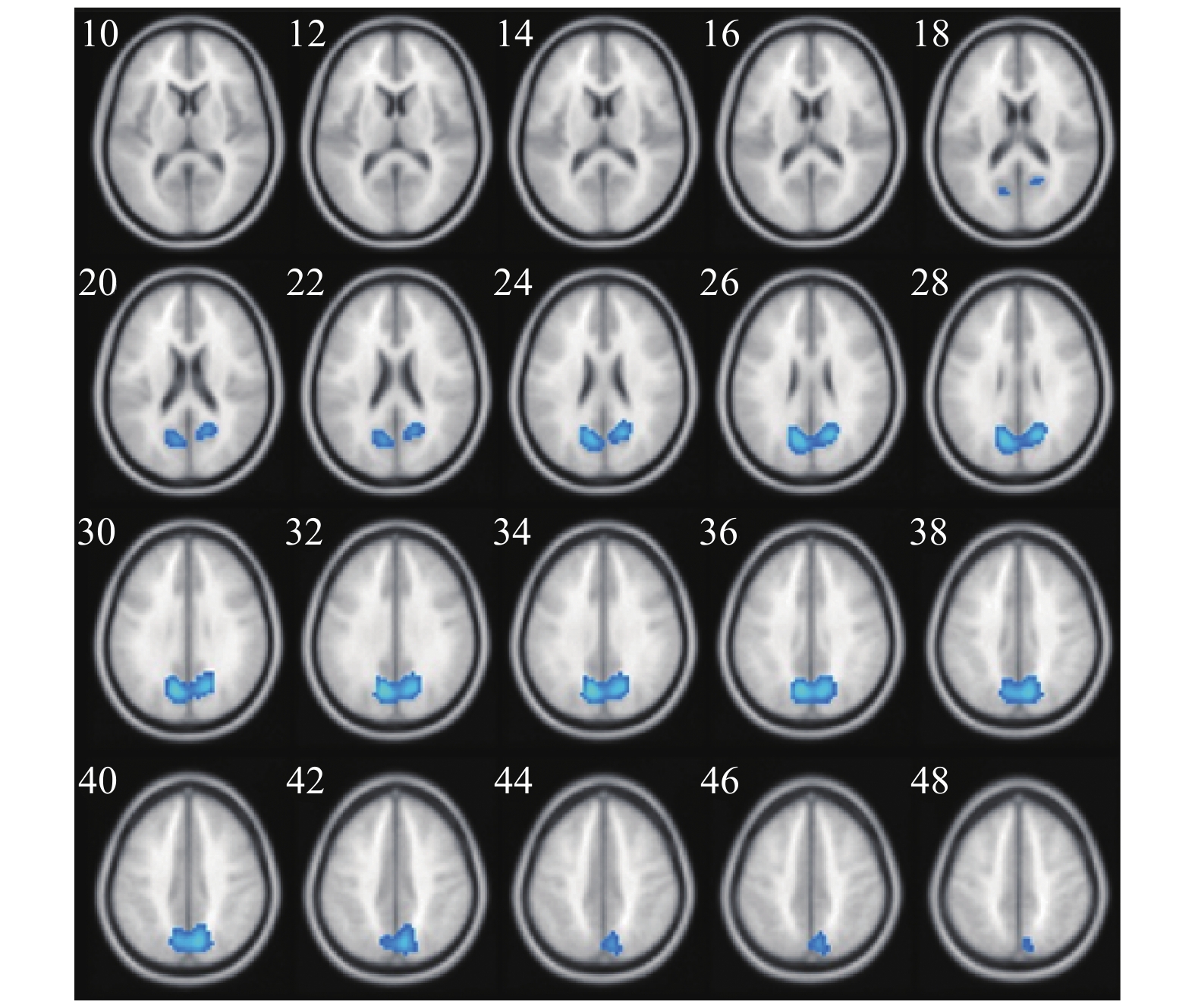
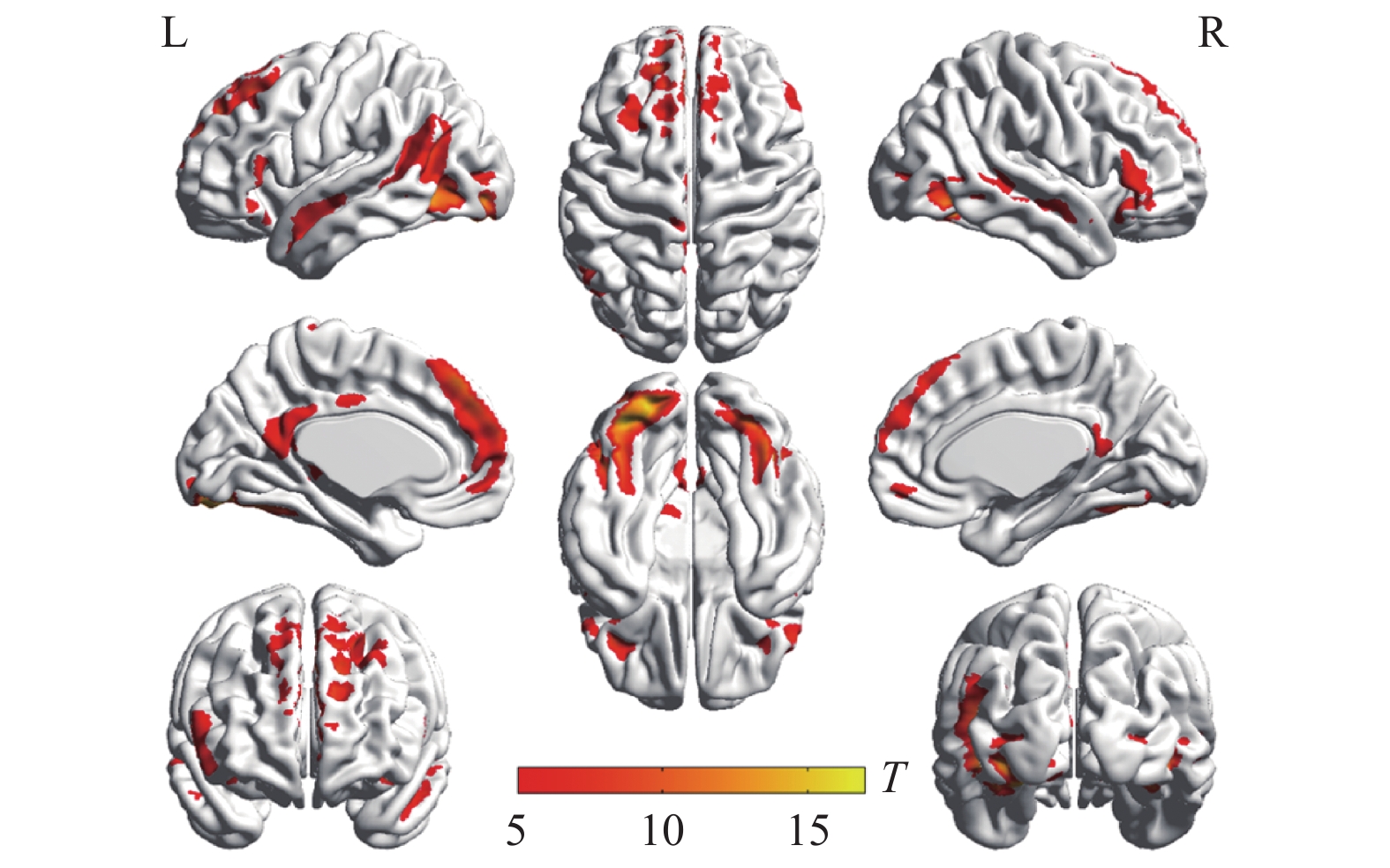
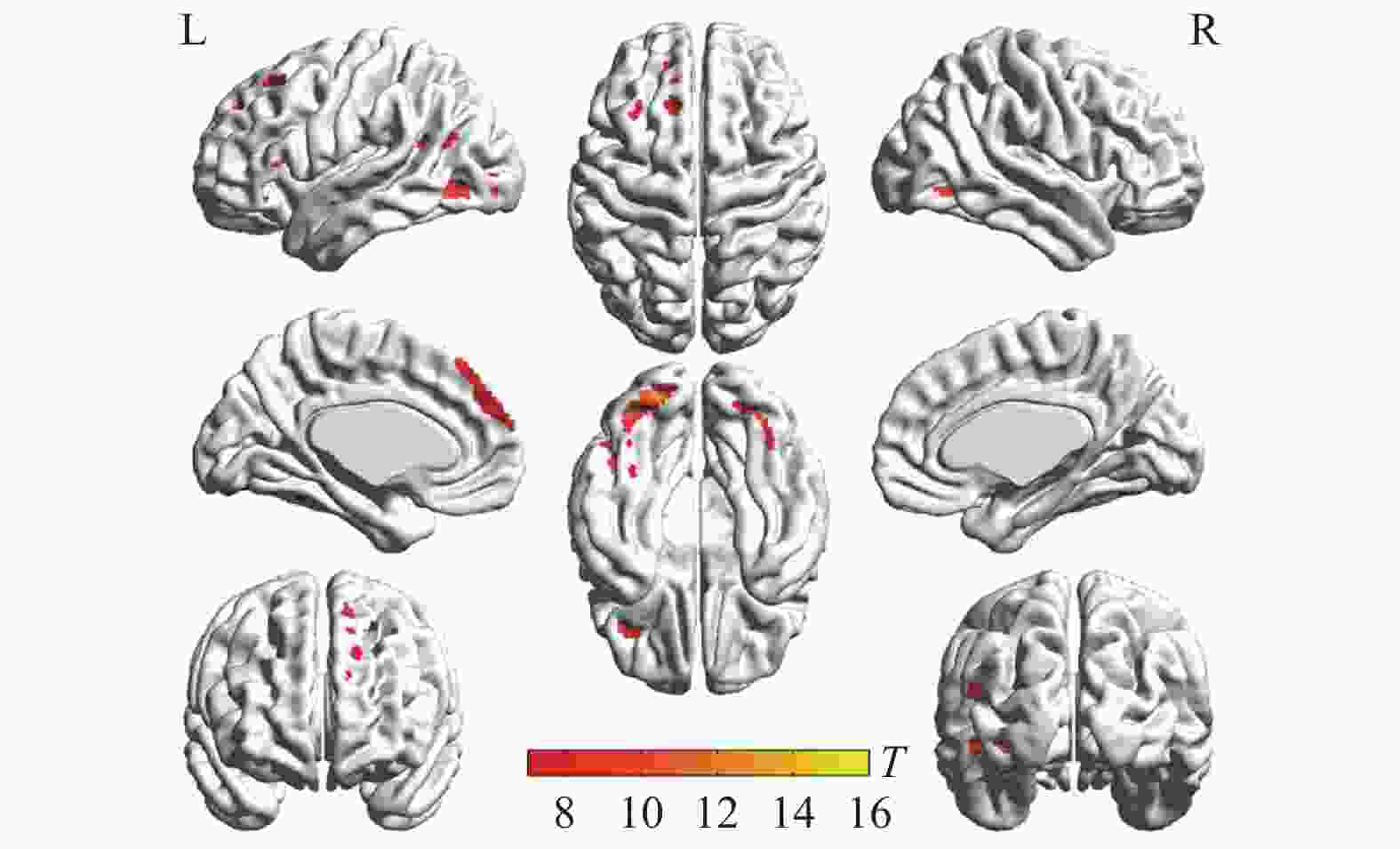
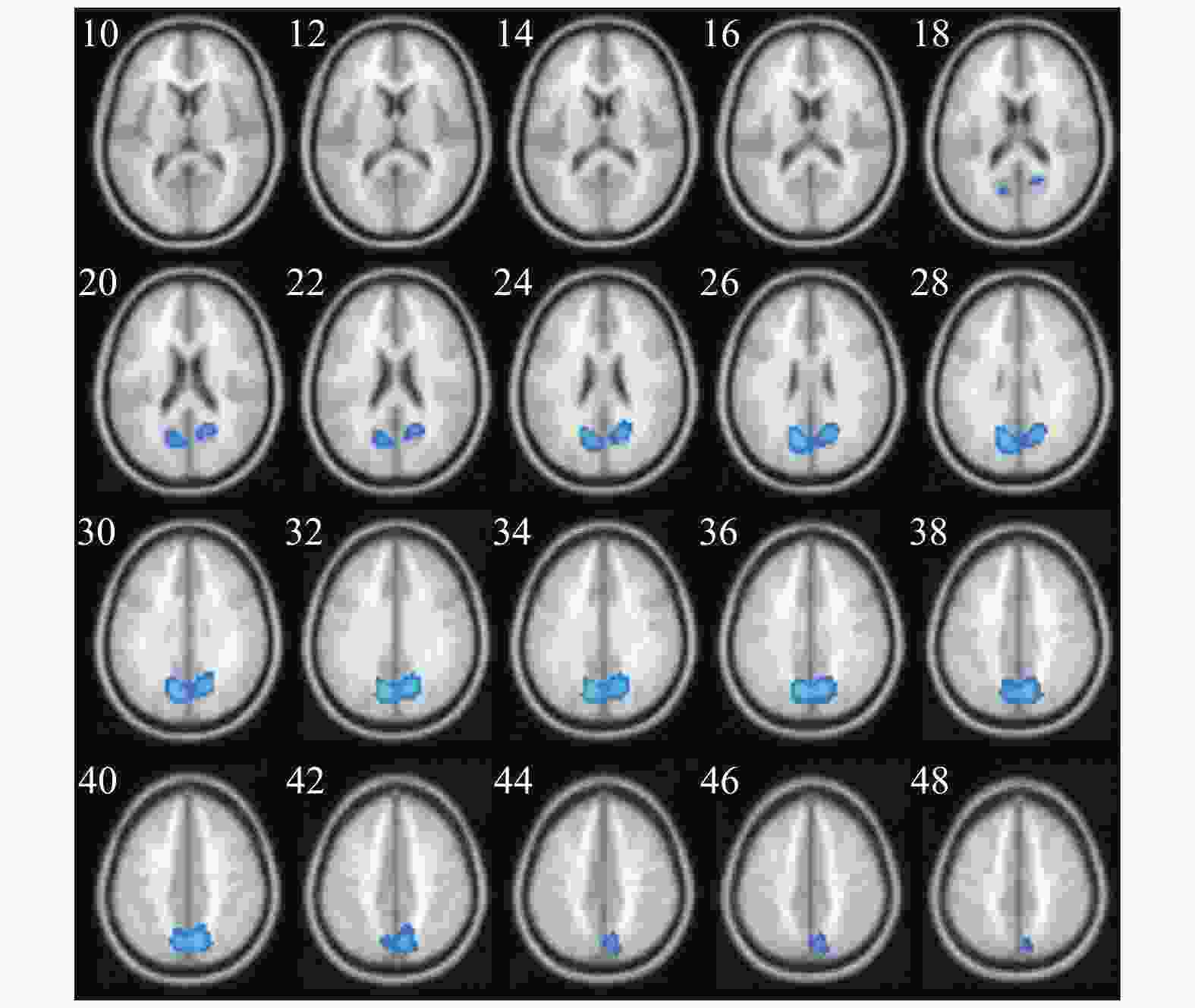
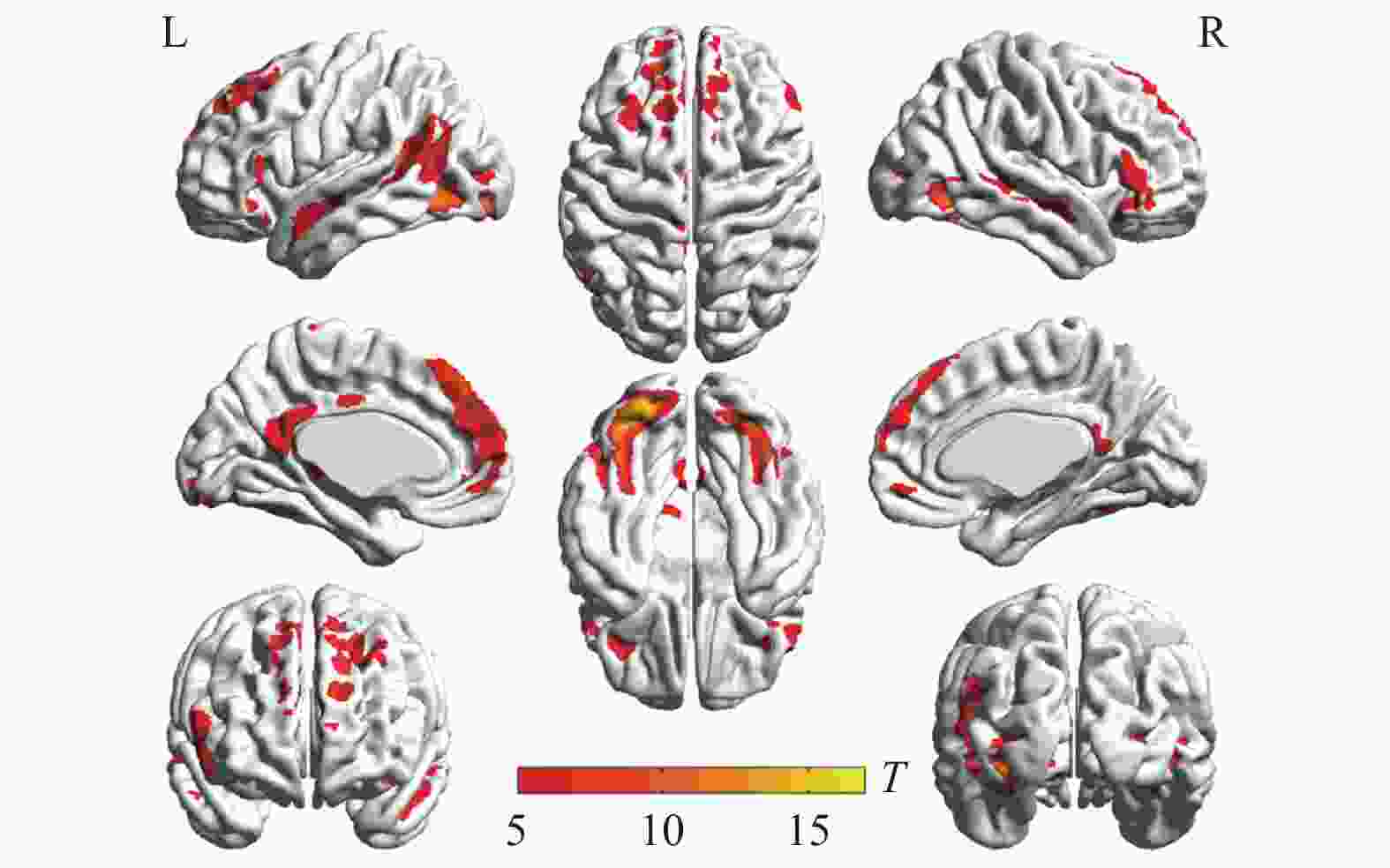
两种词类记忆编码共同激活的脑区包括左侧枕下回、左侧额上回、左侧辅助运动区、左侧角回、右侧舌回、右侧颞下回、双侧梭状回以及双侧额下回(如表1与图2所示)。将每两个mini-block间隔时间的大脑活动水平作为基线,执行任务时,大脑活动水平高于基线水平的情况视作正激活,大脑活动水平低于基线水平的情况视作负激活。具体词显著正激活了左侧枕下回、左侧额上回、左侧顶下小叶、右侧颞下回、右侧梭状回以及左侧中央旁小叶(表2和图3);显著负激活了双侧楔前叶(表2和图4)。与基线相比抽象词显著正激活了双侧梭状回、双侧颞中回、双侧舌回、左侧额上回以及右侧额下回(表3和图5);没有发现抽象词记忆显著负激活的脑区。
脑区 半球 簇团大小 MNI坐标 t值 x y z 枕下回 左 791 −33 −84 −12 15.07 枕下回 左 −21 −90 −12 13.72 梭状回 左 −39 −60 −18 12.06 舌回 右 543 24 −84 −9 13.66 颞下回 右 42 −60 −12 12.36 梭状回 右 39 −54 −18 10.61 额上回 左 616 −12 48 42 12.35 内侧额上回 左 −6 42 48 10.51 辅助运动区 左 −12 21 63 10.27 额下回眶部 左 117 −42 30 −15 10.44 额下回三角区 左 −54 27 15 8.06 额下回三角区 左 −51 33 3 7.63 角回 左 207 −39 −63 21 9.84 额下回三角区 右 95 51 27 12 7.38 额下回眶部 右 51 27 −6 6.57 额下回三角区 右 51 39 9 6.34 颞上回 左 67 −54 −6 −12 7.25 脑区 半球 簇团大小 MNI坐标 t值 x y z 枕下回 左 1183 −33 −84 −12 15.07 枕下回 左 −21 −90 −12 13.72 梭状回 左 −39 −60 −18 12.06 舌回 右 670 24 −84 −9 13.66 颞下回 右 42 −60 −12 12.36 梭状回 右 39 −54 −18 10.61 额上回 左 718 −12 48 42 12.35 内侧额上回 左 −6 42 48 10.51 辅助运动区 左 −12 21 63 10.27 额下回 左 314 −42 30 −15 10.44 额下回 左 −54 27 15 8.06 额下回 左 −51 33 6 7.65 颞中回 左 300 −39 −63 21 9.84 枕中回 左 −33 −75 27 6.14 海马 右 115 30 −9 −18 7.57 颞上极 右 33 3 −21 6.21 杏仁核 右 24 0 −18 6.08 额下回 右 125 51 27 12 7.38 额下回 右 51 27 −6 6.57 额下回 右 51 39 9 6.34 颞上回 左 76 −54 −6 −12 7.25 颞中回 右 45 57 −3 −15 6.67 中央旁小叶 左 89 −3 −24 66 6.54 中央旁小叶 左 −9 −27 75 6.16 楔前叶 左 620 −9 −69 33 12.35 楔前叶 右 9 −69 39 11.09 楔前叶 右 18 −63 27 10.53 脑区 半球 簇团大小 MNI坐标 t值 x y z 枕下回 左 1255 −33 −84 −12 16.34 舌回 左 −24 −87 −15 15.70 梭状回 左 −39 −60 −18 14.05 梭状回 右 607 42 −60 −15 14.00 枕下回 右 33 −78 −9 12.11 舌回 右 24 −84 −9 10.68 内侧额上回 左 997 −6 42 48 12.11 额上回 左 −12 51 36 10.79 额上回 左 −21 33 54 9.16 额下回 左 120 −39 30 −15 8.93 额下回 左 −51 30 −3 6.59 额下回 左 −57 27 6 6.33 颞中回 左 122 −57 0 −18 8.76 颞中回 左 −57 −15 −9 6.47 颞下回 左 −48 3 −33 6.35 额下回 右 161 42 30 −12 7.79 额下回 右 51 33 −3 7.62 额下回 右 54 33 9 7.06 楔前叶 左 118 −3 −51 15 6.95 后扣带 左 −6 −51 24 6.60 中扣带 左 −3 −36 33 5.81 颞中回 右 32 57 3 −21 5.94 颞上回 右 54 −9 −9 5.67 -
本研究探究了具体词和抽象词记忆编码的神经机制。行为结果显示,具体词记忆提取的正确率显著高于抽象词,具体词和抽象词的情景记忆效果有显著差异,符合具体性效应[1]。具体词记忆编码与基线相比和抽象词记忆编码与基线相比,fMRI数据显示,左右半球都参与了两种词类的记忆编码,但左半球的参与度更大。两种词类共同激活的区域主要集中在双侧颞枕皮层和额下回区域。具体词的记忆编码,激活了抽象词没有激活的辅助运动区,而在楔前叶这个脑区负激活的体素远大于抽象词。抽象词的记忆编码激活了具体词没有激活的扣带皮层。
双侧的颞枕皮层是文字的视觉加工的主要区域。无论是拼音文字,如英语,还是非拼音文字,如汉语,单词形式的视觉分析会激活左下侧的颞枕皮层,包括舌回、梭状回以及枕下回[25-26]。一项汉语词汇加工的研究表明,无论语音还是语义,视觉的还是听觉的,都激活了左侧梭状回、左侧颞上回、左侧额下回、左侧颞中回、左侧顶下小叶和左侧额中回。就模态而言,梭状回更多参与了视觉加工,颞上回更多参与了听觉加工;就任务而言,顶下小叶和背侧额下回更多参与了听觉加工,而腹侧额下回更多参与语义加工[27]。当两种词汇作为刺激物呈现在屏幕上时,首先都会进行视觉空间的加工,再进一步激活语义和语音表征系统。特别地,右侧的颞枕皮层(包括右侧舌回和梭状回)在表意文字(如汉语)而不是表音文字的加工中被激活[28],右侧梭状回特别地涉及汉字的辨识,该脑区对汉字的不同笔画和偏旁进行视觉空间加工[26]。在一项以英文词汇作为刺激词的词汇判断任务中,fMRI结果显示激活的绝大多数脑区与本研究中抽象词和具体词共同激活的脑区相同,但是没有显示枕下回的激活,进一步说明颞枕皮层对表意性文字加工具有特殊意义[29]。
所有语言加工都会自动激活语音表征[30],现代汉语有大约72%的形声字,声旁有利于汉字从语音方面识别。左侧颞上回对于阅读文字至关重要[31],包括语音−字母匹配度高的拼音文字和语音−书写不直接匹配的非拼音文字,如汉语[32]。自动的语音和词汇语义分析强烈激活了该脑区,说明颞上回支持着自动的词素解构和语音加工,对词素−音素的加工起着关键作用[33]。颞上回连同辅助运动区以及额下回组成一个功能性网络参与语音加工和语言表达[34-35]。两种词类的记忆加工共同激活了这些脑区,说明在记忆编码过程中,语音表征被自动激活了。
颞上回作为“语音特定区域”只会被人类有意义的声音激活,该脑区对词汇语义启动很敏感[36],是词汇语义提取的关键脑区,参与完成语义关联任务[37]和语义分类任务[38]。颞上回负责将字位转换为音节并通过语音网络将之保留在工作记忆中,并进一步在角回进行概念的加工。左侧角回调节精细的语义整合,将呈现的词汇整合成有意义的表征,以便更好地完成记忆任务,具有“情景缓冲区”的作用[39-40]。该脑区的激活程度能够在一定程度上预测后续提取任务的准确率[41]。两种词类就语义而言组织方式不同,抽象词通过相互关联的方式组织起来,而具体词通过相似性组织起来[6],都有可能在颞上回启动,并在颞上回和角回进行语义的关联。左侧额下回是语言的执行控制区域,一项元分析指出后侧和背侧的额下回,即岛盖部,参与了语音加工,而前侧和腹侧的额下回,即三角区和眶额区,则参与了语义加工,同时也参与了汉语和拼音文字的语音加工[42],这使得额下回成为语音和语义控制的交汇点。具体词和抽象词的记忆受到了前额叶的语音和语义控制。一项关于两种词类语义加工的研究得到了相似的结论,它发现具体词和抽象词共同激活了词汇语义系统,包括背侧前额叶皮层、左侧颞中回、颞下回和角回[38]。
具体词记忆更多激活了大脑左侧,这与双编码理论并不吻合,该理论认为具体词同时激活位于左半球的语言加工系统和位于右半球的意象加工系统。对比以英语具体词为刺激词的磁共振研究,都激活了双侧梭状回、双侧额下回、左侧颞上回和左侧颞中回[43],激活区域主要集中于额叶的执行控制区、颞叶的语言加工区、视觉联合皮层以及感觉运动皮层。有研究认为,具体词更多基于感觉运动和手部运动系统[44-45],激活运动皮层的辅助运动区[46]、躯体运动感觉区的中央旁小叶[47]、负责视觉空间注意的舌回[48]和负责语音表征的颞上回[49]。一项以拼音文字为刺激词的荟萃分析表明,相对于抽象词,具体词更多激活了后扣带、楔前叶、梭状回以及海马旁回[16]。本研究结果却没有发现后扣带、楔前叶、海马旁回等负责视觉空间想象的脑区,其原因可能是该荟萃分析是基于具体词和抽象词的激活对比图得到的结论,表明具体词比抽象词加工更多依赖于视觉空间想象。本研究因为基线是mini-block之间的时段的脑活动,在该过程中可能默认脑网络比较活跃,而后扣带和楔前叶是默认脑网络的核心区域。
抽象词记忆更多激活了大脑左侧,对比以英语抽象词的为刺激词的磁共振研究,都激活了双侧梭状回、扣带、双侧额下回、左侧额中回、左侧颞中回以及右侧颞上回,激活区域集中在额叶的执行控制区、颞叶的语言加工区、视觉联合皮层以及默认脑网络。特别地,在抽象词的记忆激活了内侧额上回、楔前叶、后扣带和中扣带,这些脑区都是默认脑网络的核心脑区。抽象词记忆加工时,部分脑网络的活跃程度超过基线水平。默认脑网络表征社会图示的习得[50]、离散情感[51]、情景记忆[52]以及视觉空间想象[53]。多重表征理论认为,基于概念习得机制抽象词在感觉运动、情感、社会以及语言等方面得到表征[54]。抽象概念基于内感受经历[44],在语言区、视觉联合区以及默认脑网络的表征受到执行控制区域的选择和整合,进一步完成语义加工和记忆任务。根据具身认知理论[54-55],具体词主要由感觉和运动信息表征;而抽象词的表征范围除了感觉和运动信息外,还涉及社会、情感、内感觉等方面,因此信息搜索范围宽,难度大。这可能是造成具体性效应的部分原因。多数以拼音文字加工为研究对象的磁共振实验结果都指出中央执行控制区域额下回和语言加工的核心区域颞中回在抽象词加工中的核心作用,鲜有提到默认脑网络的作用。本研究的范式是典型的情景记忆范式,而楔前叶、后扣带等是负责情景记忆的核心脑区[53],更多参与了抽象词情景记忆加工。
-
本文通过使用fMRI探究了抽象词和具体词记忆编码引起的大脑激活情况,并进一步分析了两种词类记忆加工的神经活动的差异。两种词类的记忆加工都主要激活了颞枕皮层和左侧额下回,其中抽象词记忆更多激活了默认脑网络,具体词记忆更多激活了感觉运动皮层。具体词主要由感觉和运动信息表征;而抽象词主要涉及社会、情感、内感觉等方面的表征。未来的研究拟通过经颅磁刺激等脑干预手段进一步探究辅助运动区的活动与具体词记忆加工的因果关系以及扣带皮层的活动与抽象词加工的因果关系。
本文的研究局限是刺激词为汉语,无法直接对比其加工的脑机制与拼音文字的差异,只能通过研究结果的对比来初步探寻汉语具体词和抽象词加工的特异性脑区。枕下皮层、楔前叶、扣带等脑区对汉语词汇记忆加工,特别是汉语抽象词的加工,是否有特异性贡献,有待进一步验证。
Neural Mechanism Subserving Memory of Chinese Abstract and Concrete Words
doi: 10.12178/1001-0548.2023103
- Received Date: 2023-04-11
- Rev Recd Date: 2023-07-09
- Available Online: 2024-04-01
- Publish Date: 2024-03-30
-
Key words:
- abstract words /
- concrete words /
- functional magnetic resonance imaging /
- neural mechanism
Abstract: The neural mechanism subserving the processing of abstract and concrete words is widely studied in cognitive neuroscience. The previous studies focused on the alphabetic languages, which found that the processing of abstract words relies more on verbal system and the processing of concrete words relies more on perceptual system. This study investigates the brain activity elicited by the abstract and concrete words in the process of the memory encoding with functional magnetic resonance imaging. The results are that the memory encoding of the two types of words activates temporal-occipital cortex and left inferior frontal gyrus. Besides, abstract words elicit default mode network additionally while concrete words elicit sensorimotor cortex additionally. The results indicate that the memory of the abstract and concrete words activates verbal and executive control systems, but they also rely on different systems for memory encoding.
| Citation: | YAN Jing, LI Wenjuan, ZHANG Tingting, ZHANG Junjun, JIN Zhenlan, LI Ling. Neural Mechanism Subserving Memory of Chinese Abstract and Concrete Words[J]. Journal of University of Electronic Science and Technology of China, 2024, 53(2): 299-306. doi: 10.12178/1001-0548.2023103 |

 ISSN
ISSN 







 DownLoad:
DownLoad: