-
肝纤维化是许多肝脏疾病尤其是慢性肝病的一个共同病理基础[1]。慢性肝纤维化程度的评估是判断病情、早期干预治疗和随访疗效的关键环节[2]。一直以来肝活检通常被当作肝纤维化诊断的金标准[1-2]。然而,肝活检本身存在着给患者带来风险伤害、取样误差以及不可忽视的发病和偶尔的死亡率等问题[3]。无创准确测量肝脏组织的粘弹性在临床中意义重大[4-5],非创伤性诊断标志物和非创伤性影像学检查成为人们一直研究的方向。其中血清标志物作为目前无创肝纤维化诊断的有力工具,但对于肝纤维化早期的微小改变也无法准确区分。
近年来,已有将弹性像技术应用于肝纤维化的临床检测[12-14]。例如文献[6]弹性成像就是其中一种,它是通过获取剪切波的传播速度对肝纤维化程度进行诊断[6]。文献[7]基于超声辐射力弹性成像技术也应用于肝纤维化的诊断,和文献[6]一样,通过辐射力激励后得到剪切波的传播速度,间接反映肝纤维化程度。但是,文献[8]提出肝纤维化指标F0~F3与健康肝脏在剪切波速上的差异只有1%,而对比于肝硬化也仅超过健康肝脏2%,对于健康和疾病肝脏在剪切波速上的微小差异,可能无法有效区分病变的等级。同时,剪切波本身易衰减不易测量等问题使得测量准确性有待进一步提高[9]。
基于以上问题,本文利用超声脉冲辐射力技术基础,提出了一种对肝纤维化不同分期对应的弹性参数标准化定量量化的方法:通过间隔发射激励脉冲和检测脉冲对组织运动进行追踪,得到组织激励前后的纵向位移(即应变)情况;对不同肝纤维化程度兔子肝脏进行ARFI实验以观察不同肝纤维化分期的应变变化情况;再基于肝脏组织粘弹特性的特点,利用Voigt模型对已知弹性的弹性小球和背景材料(8、14、25、45、80 kPa)进行实验建立弹性系数-应变(相位)变化的拟合曲线;最后结合弹性系数-应变(相位)变化拟合曲线实现不同分期肝纤维化弹性系数的定量量化。
HTML
-
实验基于声泰特C21iMago超声彩色多普勒实验仪搭建了超声辐射力脉冲激励和运动跟踪系统。图 1显示了该系统的激励和检测声波序列。该序列由1个标准波束、1个激励波束和24个检测波束构成,3种波束均为正弦脉冲。
其中标准脉冲和检测脉冲用于组织运动位移的检测,脉冲宽度为2个周期(cycle),而激励脉冲用于产生声辐射力推动组织产生瞬时纵向运动,它是提高了发射能量的和增加了脉冲发射时间的聚焦波束。激励脉冲的宽度一般为30~200个周期(cycle),具体cycle数根据要施加的超声辐射力大小决定。相邻两波束间时间间隔为重复扫描时间间隔。
每一个位置生物组织的弹性相关的纵向位移信息的获得就由聚焦于该位置的一组激励和检测声波序列完成。
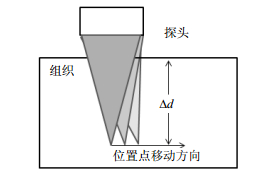
首先,施加标准波束获得标准回波信号,如图 2a所示;然后施加激励波束,获得激励回波信号,如图 2b所示;最后施加24个检测回波,每施加一个检测回波就获得一个检测回波信号,如图 2c和2d所示,其分别是第一个和第二个检测回波信号。有了这些回波信号,便可计算出检测对象的瞬时纵向位移信息(具体计算方法见1.2节)。当一个位置点的信息被记录完成后,系统将会如图 3所示,在相同深度Δd下,沿一个方向改变聚焦位置,对同一深度的其他位置点进行逐点重复的激励和追踪工作。
-
根据课题组之前的研究,应用相位累积型自相关算法实现微小位移的检测[11]。该方法将信号差异累积起来再进行统一估计,减少了反正切计算中的误差,有更好的平滑效果。具体算法简述如下:
信号回波可以描述为:
式中,g(t)为信号瞬时包络函数;ω0为探头中心角频率;φ0为初始相位。
则第0次回波信号可描述为:
第k次回波信号为:
式中,Δφ(t, k)为第k次扫描回波相对于第0次扫描回波的相位差异。
图 4为检测到的一组检测回波信号,横轴方向每一条曲线为一次回波信号,可见当物体发生纵向运动时,信号间出现相位差异。
通过公式推导(详见参考文献[11]),利用相位累积型自相关算法相位差异计算式为:
式中,m是计算深度(即某个纵向位置);n是取样窗口;Z(m, k)表示在m点采集到的第k个检测回波信号。通过式(4)即可计算出m位置点处两个相邻回波信号间的相位差Δφ。因为相位变化与位移成正相关[17],所以用相位变化曲线即可以表示位移变化。
-
大量研究表明,黏弹性(viscoelasticity)是反映生物组织力学特性的最佳指标[2-3]。本小节基于Voigt粘弹性模型,获得应变与弹粘性系数之间关系的解释式,从而为后面弹粘性体纵向位移与弹性系数的关系曲线的拟合做准备(见2.1节)。
已知Voigt模型的应力-应变关系如下:
式中,σ为施加的应力;E、η分别为弹性系数和粘性系数;ε为应变;dε/dσ为应变微分。
通过求解上述一阶线性微分方程得到:
式(6)显示了应变与应力、弹性系数和粘性系数的关系。试验中对一组弹性系数为(8~80 kpa)的粘弹性小球和弹性系数为25 kpa粘弹性背景材料施加声辐射力,完成一组实验。每组实验中,保持激励波束的电压(即声功率)以及cycles数目恒定,相当于式(6)中的σ恒定。然后采用1.2节介绍的相位累积自相关算法得到激励后相应粘弹性材料的纵向位移,由于激励波束的聚焦面积恒定,故用纵向位移代替式(6)中的应变ε。最后将一组实验中的各个纵向位移值标记在弹性系数-位移平面上,再用式(6)对散点进行曲线拟合,获得一条Vogit模型下的弹性系数与纵向位移的关系曲线。如果采用的力学模型不同则关系曲线的形态不同。之后,再改变激励波束的电压或者cycles数目,重复上述过程,从而获得不同应力下综合的弹性系数与纵向位移的关系曲线。
有了弹性系数与纵向位移的关系曲线,便为量化肝纤维化弹性系数提供了标准。
1.1. 超声辐射力脉冲激励和运动检测波束
1.2. 组织纵向位移的计算
1.3. 弹性系数与纵向位移的关系曲线
-
本文的实验动物采用兔子,共17只,随机分为对照组和实验组。兔子、饲料及其喂养工作均由四川大学动物实验中心提供。
实验对兔子注射四氯化碳(Carbon Tetrachloride)来建立肝纤维化模型。兔子分为模型组14只和对照组3只,模型组包含肝纤维化F1~F4期,对照组为F0期(正常期)。在培养阶段,对照组一直给予正常的水和食物。模型组的造模按以下步骤来进行:第一周开始,按0.3 mL/100 g体重给每只兔子皮下注射两次CCl4和橄榄油的混合液(体积比1:1)。通过控制对兔子注射的天数,将其诱导成肝纤维化的不同分期。这样,分别于第5、9、13、17周后进行ARFI实验,实验时取大小约1 cm×0.5 cm×0.5 cm样本组织两片进行组织病理学分析,分期结果为F1期3只、F2期4只、F3期5只、F4期2只。
-
17只兔子共分为4次实验采集完成,分别于第5、9、13、17周后对兔子进行声辐射力实验。每次实验前兔子空腹3 h后腹部脱毛,静脉麻醉后固定兔子采取仰卧位解剖,取出兔子肝脏(取最大肝叶)在10 min内完成实验,采集完成获取回波信号,从而避免了肝脏组织离体时间过长对实验过程以及结果数据的影响。文中激励波束的参数由声功率和cycle个数控制,探头中心频率为5 MHz,采样频率40 MHz,重复频率8 kHz。回波信号中,每一帧共有624束波束,共采集26个位置,每个位置每次采集24个包络数的声束,每根声束由592个数据点组成。采集每次超声辐射力激励后组织的回波RF信号如图 2所示。
累积型相位即表示纵向位移的变化(本文中累积相位个数n=12),结合式(4)的累积相位计算方法,得到组织的受激励后同一位置24个包络波束的累积相位变化图,如图 5所示。
图 5可以看出在受到声辐射力激励后,组织相位变化迅速,在第2个回波处纵向位移达到最大值。同时,纵向位移的最大值随着电压值的增大而增大。
-
使用激励检测系统对17只兔子肝脏26个位置进行激励和应变追踪,根据施加声功率和声数数目的不同,得到不同声功率和声束宽度条件下,各个兔子肝脏累计相位最大值,取26个位置的平均值显示,如表 1所示。这里累计相位最大值就作为组织聚焦部分的瞬时纵向应变。
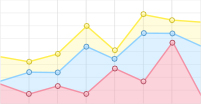
激励脉冲宽度/cycles F4 F3 F2 F1 F0 20 1.858 4 1.927 8 2.016 5 2.089 1 2.067 0 40 1.895 5 1.969 5 2.043 3 2.120 6 2.099 2 70 2.008 3 2.020 4 2.081 1 2.190 2 2.195 3 100 2.034 1 2.079 7 2.188 0 2.269 0 2.290 6 120 2.083 1 2.159 9 2.206 4 2.319 1 2.424 3 140 2.130 0 2.202 3 2.232 2 2.366 1 2.433 2 170 2.132 7 2.216 9 2.269 6 2.427 9 2.584 4 200 2.151 5 2.228 6 2.320 7 2.481 5 2.530 9 将不同电压下的肝纤维化不同分期的累积相位绘制成曲线。如图 6所示。
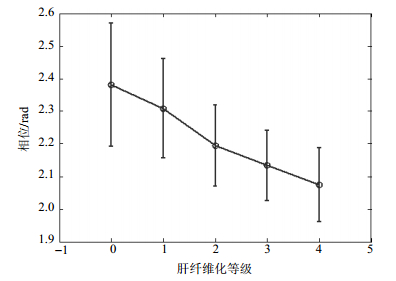
从图 6可以看出,总的趋势是累积相位变化随肝纤维化程度的加深而减少,但是脉冲宽度小于100 cycles的时候,对肝纤维化程度的区分不稳定,甚至出现错误。比如50 V/40 cycles条件下F1期较F0期小。鉴于此,本文将相同激励电压下不同脉冲宽度(20~200 cylcles)获得的累积相位进行累加,计算其平均值。用平均值的大小来表现不同程度的肝硬化。其分级效果如图 7所示。
从图 7可以看到,在各个声功率条件(30 V、50 V、60 V)下多个脉冲宽度获得的累积相位求平均都能明显地区分出肝纤维化程度,说明利用超声激励脉冲对肝纤维化分级的有效性。但是,在30 V条件下,F3期和F4期的区分没有50 V和60 V条件下的明显,同时脉冲宽度小于100 cycles的时候,对各期的区分也不稳定,这可能是由于激励脉冲的力量不够,加上信号采集中噪音的影响造成的。鉴于此,本文将分级方案调整为:将50 V和60 V激励电压下脉冲宽度为100~200 cylcles之间获得的累积相位进行累加,计算其平均值,即每个肝纤维化分级的纵向位移情况是10个累积相位求平均,其分级效果如图 8所示。
图 8表明,从F0期~F4期实现了对肝纤维化的分级,从而也证明ARFI在肝纤维化分级中的可行性。同时得到了ARFI试验中最佳的辐射力强度和脉冲宽度。
-
为了量化不同分期的肝纤维化组织的弹性系数,需要做出一条标准的弹性系数与纵向位移的关系曲线,然后在这条曲线上找出某个纵向位移对应的弹性系数,从而得到不同肝纤维化分期的肝脏弹性系数值。
实验采用CIRS公司的Model049模型。Model049是一款专门用于超声弹性成像研究的模型,其由4种弹性系数不用的小球和弹性背景组成,类型,Ⅰ~类型Ⅳ的小球小球的弹性系数分别为:8、14、45、80 kPa,背景区域为25 kPa,Model049模型如图 9所示,其中每种类型的弹性小球均有2个,其大小和位置如图 9所示。
前面提到,30 V条件下组织受激励后累计相位变化值不明显;同时,测试phantom时发现对45、80 kPa的粘弹性小球进行声辐射力激励后,累计相位值微弱且很不稳定。故此处分别采用50 V/60 V的声功率以及100 cycles/200 cycles的激励脉冲宽度条件下对位于离顶面15 mm的4个直径10 mm的小球和背景进行激励,然后计算其纵向位移,结果如表 4所示。其中纵向位移我们采用累积相位表示。
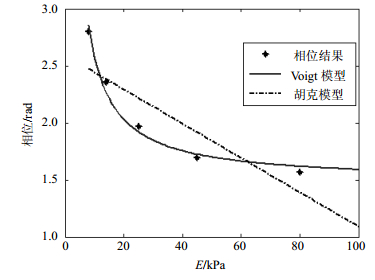
条件 80 kPa 45 kPa 25 kPa 14 kPa 8 kPa 50 V/100 cycles 1.513 1.589 1.765 1.914 2.355 50 V/200 cycles 1.518 1.592 1.866 2.131 2.758 60 V/100 cycles 1.601 1.726 2.012 2.657 2.952 60 V/200 cycles 1.641 1.867 2.224 2.725 3.032 在已知声辐射力激励条件下,建立弹性系数-应变(相位)变化,整合50 V、60 V各个条件取平均值,根据式(6)建立拟合曲线,得到在此条件下的弹性-应变关系曲线,如图 10所示。
如图 10所示,在已知声辐射力条件下建立的弹性应变关系图,即在50 V、60 V条件多次测量的累计相位结果取平均值,因为已知弹性小球的杨氏模量,借助力学Voigt模型建立弹性系数与应变的拟合关系。表 5给出了胡克和Voigt模型的拟合的误差结果。拟合误差计算如式(7)所示。
模型 胡克模型 Voigt模型 拟合误差 0.251 4 0.016 9 式中,S为均方差;n为数据点个数(文中n=5);Pi为原始数据值;L(Pi)为对应的拟合值。
结果显示,粘弹性Voigt模型的拟合误差值仅0.016 9。后文在此基础上利用在Voigt模型条件下的弹性系数-应变关系,可对当前条件下测量得到应变值进行弹性系数的估计。
-
结合上一节中得到的综合条件下弹性系数与应变的拟合变化关系。结合不同肝纤维化的兔子肝脏受辐射力激励后的纵向值(累计相位平均值),可以得到对应条件下不同肝纤维化兔子肝脏的弹性系数,统计结果如表 6所示。
等级 F0 F1 F2 F3 F4 量化结果/kPa 11.95±1.91 13.28±1.89 15.40±1.98 16.83±2.01 18.52±2.28
2.1. 实验对象
2.2. 信号采集
2.3. 肝纤维化分级
2.4. 弹性系数与累积相位关系
2.5. 量化肝纤维化弹性系数
-
本文利用超声辐射力脉冲技术推动聚焦处组织产生微小纵向位移,借此评估该瞬时纵向位移对分级肝纤维化的可行性。通过动物实验发现,如果只用一种辐射力一种脉冲宽度的纵向位移进行分级结果并不稳定;同时脉冲宽度低于100 cycles时获得的结果也不稳定。最后采用了50 V和60 V两种强度下100~200 cycles之间获得的所有纵向位移的平均值作为分级标准,结果表明不同程度的肝纤维化获得了较好的区分。之后,本文基于Model 049弹粘性体模型,建立弹性系数-纵向位移(相位)关系曲线,该关系曲线利用Voigt粘弹性力学模型进行拟合,能表征生物组织的粘性和弹性两个方面的特征,其数据误差0.016 9,远小于采用纯弹性胡克模型数据误差0.251 4。最后,在Voigt拟合曲线中找出不同肝纤维化的纵向位移值所对应的弹性系数,从而量化出不同肝纤维化分期。结果表明,不同分期的肝脏弹性系数有较大差异,F0与F1之间差11.13%,F1与F2之间差15.96%,F2与F3之间差9.29%,F3与F4之间差10.04%。
本文的研究为临床上肝纤维化的无创准确检查和诊断提供了新的方法和手段。进一步的研究将加大动物实验的数据量,采用不用种类的动物(如大鼠、猪等),提高信号的检测精度,实现在体实验等。

 ISSN
ISSN 

















 DownLoad:
DownLoad: